网址:http://m.1010jiajiao.com/timu_id_469500[举报]
必考卷
第Ⅰ卷共18小题,每小题6分,共108分。
一、选择题:选对的给6分,选错的得0分。
1.C 2.B 3.C 4.B 5.B
6.C 7.B 8. B 9.D 10.B 11.A 12.A
二、选择题:全部选对的给6分,选对但不全的给3分,有选错的得0分。
13. A 14. BC 15. B 16. CD 17.C 18. A
第Ⅱ卷共9题,共161分。
19.(1)A(4分);
(2)如图(4分);
(3)半导体(3分);(4)4.0V(2分)、0.40Ω(2分);(5)1.990(3分)
 20.(15分)解:设屋檐距窗户下沿的高度为h,则有:
20.(15分)解:设屋檐距窗户下沿的高度为h,则有:
h=gt12 4分
h- 1.4=gt22 4分
t1-t2=0.2 4分
得h=
21.(19分)
解:(1)质点在磁场中作半径为R的圆周运动,
qvB=m,得R= 4分
T== 2分
带电粒子在磁场中的运动时间t= = 2分
(2)根据题意,质点在磁场区域中的轨道是半径等于R的圆上的1/4圆周,这段圆弧应与入射方向的速度、出射方向的速度相切。过a点作平行于x轴的直线,过b点作平行于y轴的直线,则与这两直线均相距R的O′点就是圆周的圆心。
质点在磁场区域中的轨道就是以O′为圆心、R为半径的圆(图中虚线圆)上的圆弧MN,M点和N点应在所求圆形磁场区域的边界上。 2分
在通过M、N两点的不同的圆周中,最小的一个是以MN连线为直径的圆周。 2分
 所以本题所求的圆形磁场区域的最小半径为
所以本题所求的圆形磁场区域的最小半径为
MN=R 3分
r=MN 2分
得r= 2分
所求磁场区域如图中实线圆所示.
22.(20分)
解:小球到达板上端时竖直分速度  2分
2分
设小球此时速度方向与竖直方向之间的夹角为θ ,  2分
2分
在电场中小球所受合外力方向与运到方向相同,设板间距离为d
tanθ = = 2分
L= 2分
解得: 2分
2分
(2)进入电场前  4分
4分
电场中运动过程  4分
4分
解得: 2分
2分
23、(15分)
(1)CO32―(1分)
(2)Cl2+2I―=2Cl―+I2 (3分) I―(1分) NO3―、 Fe3+(2分)
(3)Al3+、Mg2+(2分) C(Mg2+)?C(OH-)2 (2分)
(4)Ba2+ (1分) SO42―(1分) Cl―、K+ (2分)
Cl―、K+ (2分)
24、(16分)
(1)离子键和共价键(1分) 1:2(1分)
(2)2Na2O2+2H2O
=4NaOH+O2↑(2分) 2 mol(1分)
(3)碱 (1分) CO32-+H2O HCO3-+OH- (2分)
HCO3-+OH- (2分)
(4)正极(2分) H2+2OH--2e-=2H2O (2分)
(5)①④ (2分) (6)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) (2分)
25.(14分)
(1)c (2分)
(2)①(Ⅰ)饱和碳酸氢钠溶液;(1分) 除去CO2中的HCl气体(1分)
(Ⅱ)吸收未反应完的NH3(1分)(答“防止倒吸”或“吸收CO
(Ⅲ)过滤 (1分) 玻璃棒、漏斗、烧杯(2分)
②(Ⅰ)a、NH3, b、CO2; (共2分)
(Ⅱ)增大气体与溶液接触面积,提高CO2的吸收率; (2分)
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可;化学方程式也可。) (2分)
26.Ⅰ.(每空1分,共8分)
(1)收缩 神经一体液调节 产热与散热
(2)肝糖元 脂肪分解为甘油和脂肪酸进入血液 增加
(3)乳酸 NaHCO3
II.(每空2分,共12分)
(1)正确 缺少对照组,应增加12/12 (小时)光/暗处理的一组小鼠
(2)避免了因为温度不同对小鼠非颤抖性产热的影响
(3)下丘脑 线粒体 甲状腺激素和肾上腺素
27.Ⅰ.(每空2分,共14分)
(1)F1在减数分裂过程中联会紊乱,形成可育配子的概率很小; 使用一定浓度的秋水仙素对幼苗或正在发芽的种子进行处理,使其染色体数目加倍; 八
(2)将杂交后代与普通小麦反复杂交
(3)①突变和重组(或可遗传的变异) ②种群基因频率 ③生殖隔离
II.(每空2分,共8分)
(1)隐(2分) X(2分) 1/8(2分)
(2)将该只雌果蝇与种群中任一雄果蝇交配,统计子代雌、雄果蝇的数目。若子代雌、雄果蝇比例为1:1,说明该雌果蝇为纯合子;若子代雌、雄果蝇比例为2:1,说明该雌果蝇为杂合子。(2分)
选考部分
28.
29.(1)② (6分)
(2) ② (6分)
30. (13分)
(1)C<O<N (2分) (2)三角锥形 sp3 (各1分,共2分)
(3) (2分) N2O (1分)
(2分) N2O (1分)
(4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1)(2分) [Cr(NH3)4(H2O)2]Cl3(2分)
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O(2分)
31.(共13分)
⑴CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O(3分) 氧化反应(1分)
CH3COOH+Cu2O+2H2O(3分) 氧化反应(1分)
⑵
 、
、
 (各1分,共2分)
(各1分,共2分)
⑶
 (写出间位的亦可,3分)
(写出间位的亦可,3分)
⑷
 、
、
 、
、
 、
、

(以上每个结构简式1分,共4分)
32(每空一分,共8分)
(1)人工合成 同种限制 DNA连接 质粒(或动植物病毒或噬菌体等) 标记基因 (2)脱分化(或去分化) 胚状体 人造种皮
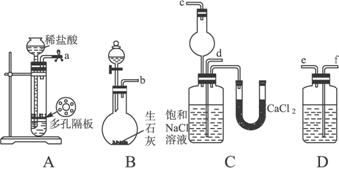
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4C1晶体析出……请回答下列问题:
(1)装置的连接顺序是:a接_______;_______接_______;b接_______。
(2)A中常选用的固体反应物为,D中应选用的液体为,B中发生反应的化学方程式为
_______________________________________________。
(3)第二步骤中必须先让_________________装置发生反应。
(4)C中用球形干燥管而不用直导管,其作用是________________________,C中广口瓶内产生固体的总化学方程式为_____________________________________________________。
(5)第四步中分离出NH4Cl晶体的操作是___________;所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:_________________________________________________。
查看习题详情和答案>>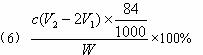
四种盐在不同温度下的溶解度(g/100 g水)表

(说明:①>35 ℃ NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是_________________________(填字母)。
(2)A装置中盛放的试剂是_________,其作用是____________________________________。
(3)在实验过程中,需要控制D温度在30—35 ℃,原因是___________________________。为了便于控制此温度范围,采取的加热方法为____________________________________。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体的原因是____________。用蒸馏水洗涤NaHCO3晶体的目的是除去___________________________杂质(以化学式表示)。
(5)将锥形瓶中的产物过滤后,所得的母液中含有______________(以化学式表示),可加入氯化氢,并进行_________操作,使NaCl溶液循环使用,同时可回收NH4Cl。
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:w(NaHCO3)=_________________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:w(NaHCO3)=_________________。
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请完成下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )

(2)A中常选用的固体反应物为____________;D中应选用的液体为____________;B中发生反应的化学方程式为_________________________________________________________。
(3)第二步骤中必须先让_______________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________________,C中广口瓶内产生固体的总化学方程式为______________________________________。
(5)第四步中分离出NH4Cl晶体的操作是___________________;其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%—8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:______________________________________。
查看习题详情和答案>>第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,又有晶体析出,……
请回答下列问题:

(1)装置的连接顺序是:(a)接(_________)![]() (_________)接(_________);
(_________)接(_________);
(b)接(_________)。
(2)A中常选用的固体反应物为_________;D中应选用的液体为_________。
(3)B装置中分液漏斗内所加试剂为_________;第二步中必须先让_________装置发生反应。c中用球形干燥管而不用直导管,其作用是_________。
(4)第四步分离所得的晶体中含有多种成分,试证明其中含有NH4CI,简要写出操作过程和现象____________________。
查看习题详情和答案>>第一步:连接好装置,检验气密性,在各仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,并用蒸馏水洗涤晶体,得到NaHCO3固体。
第四步:向滤液中通氨气,加入细小食盐颗粒,冷却析出副产品NH4Cl晶体。
请回答下列问题:

(1)装置的接口连接时a接_____________。
D中所盛试剂的名称是_____________。
(2)第二步中必须先让_____________(填编号)装置发生反应。
(3)C中用球形干燥管而不用直导管,其作用是___________________________,C中广口瓶内产生固体的总化学方程式为______________________________。
(4)第三步中用蒸馏水洗涤晶体的目的是除去______________________________杂质(以化学式表示)。
(5)向滤液中通氨气的目的是_____________。(填序号)
a.增大![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
w(NaHCO3)=________________________________________________。
查看习题详情和答案>>