题目内容
我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业作出了杰出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、CO2为原料先制得NaHCO3,再生产出纯碱。下面是实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:第一步:连接好装置,检验气密性,在各仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,并用蒸馏水洗涤晶体,得到NaHCO3固体。
第四步:向滤液中通氨气,加入细小食盐颗粒,冷却析出副产品NH4Cl晶体。
请回答下列问题:

(1)装置的接口连接时a接_____________。
D中所盛试剂的名称是_____________。
(2)第二步中必须先让_____________(填编号)装置发生反应。
(3)C中用球形干燥管而不用直导管,其作用是___________________________,C中广口瓶内产生固体的总化学方程式为______________________________。
(4)第三步中用蒸馏水洗涤晶体的目的是除去______________________________杂质(以化学式表示)。
(5)向滤液中通氨气的目的是_____________。(填序号)
a.增大![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
w(NaHCO3)=________________________________________________。
(1)f 饱和NaHCO3溶液
(2)B
(3)防止倒吸 NaCl+NH3+H2O+CO2====NaHCO3↓+NH4Cl
(4)NaCl、NH4Cl、NH4HCO3
(5)a
(6)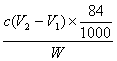 ×100%
×100%
解析:(1)A为CO2的气体发生装置,其产生的CO2中含有HCl和H2O,HCl对后续过程有不利影响,应用盛有饱和NaHCO3溶液的D装置除去,连接时a接f。(2)相对于CO2而言,NH3在饱和NaCl溶液中溶解量更大,先向c中通NH3更有利于CO2的吸收和NaHCO3的生成,所以应先让B装置发生反应生成NH3。(3)C中用球形干燥管能防止倒吸,C中广口瓶内物质能依次发生反应NH3+H2O+CO2====NH4HCO3,NH4HCO3+NaCl====NaHCO3↓+NaCl,总方程式为NaCl+NH3+H2O+CO2====NaHCO3↓+NH4Cl。(4)从溶液中析出的晶体会吸附少量可溶性杂质。用蒸馏水洗涤NaHCO3晶体的目的是为了除去吸附的NaCl、NH4Cl、NH4HCO3等杂质。(5)NH3的溶入能增大![]() 浓度而使之与Cl-一块结合为NH4Cl析出。(6)NaHCO3(总) +HCl====NaCl+CO2↑+H2O,n总(NaHCO3)=c mol·L-1·V2×10
浓度而使之与Cl-一块结合为NH4Cl析出。(6)NaHCO3(总) +HCl====NaCl+CO2↑+H2O,n总(NaHCO3)=c mol·L-1·V2×10![]() mol,w(NaHCO3)=
mol,w(NaHCO3)= 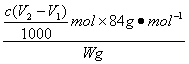 ×100%
×100%![]() ×100%。
×100%。

 名校课堂系列答案
名校课堂系列答案


 H4C1等物质
H4C1等物质 溶解度的差异,以食
溶解度的差异,以食 盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳
盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳 酸钙;D:含氨的饱和食盐水、水
酸钙;D:含氨的饱和食盐水、水

 来源:Z|xx|k.Com]
来源:Z|xx|k.Com] 5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。