题目内容
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”中制取NaHCO3的实验步骤: 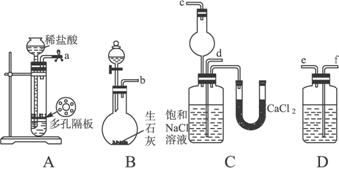
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4C1晶体析出……请回答下列问题:
(1)装置的连接顺序是:a接_______;_______接_______;b接_______。
(2)A中常选用的固体反应物为,D中应选用的液体为,B中发生反应的化学方程式为
_______________________________________________。
(3)第二步骤中必须先让_________________装置发生反应。
(4)C中用球形干燥管而不用直导管,其作用是________________________,C中广口瓶内产生固体的总化学方程式为_____________________________________________________。
(5)第四步中分离出NH4Cl晶体的操作是___________;所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:_________________________________________________。
(1)f e d c
(2)块状石灰石 饱和NaHCO3溶液 CaO+NH3·H2O====Ca(OH)2+NH3↑
(3)B
(4)防倒吸 CO2+NH3+NaCl+H2O====NaHCO3↓+NH4Cl
(5)过滤 取少量固体放入试管中加热,固体大部分消失,在试管口又有较多的固体凝结
解析:“侯氏制碱法”的实验原理是:CO2+NH3+H2O+NaCl====NaHCO3↓+NH4Cl,即制碱过程中所需的两种气体是CO2和NH3,实验室用块状石灰石和稀盐酸反应产生CO2,用浓氨水和CaO或NH4Cl和碱石灰混合制NH3。NH3极易溶于水,而CO2在水中的溶解度不大,为使CO2能更多地溶于水与NaCl反应,可先使NH3溶于水达饱和,使溶液呈碱性,这会使酸性氧化物更多地被溶解吸收。因NH3极易溶于水,故要考虑到NH3的倒吸问题。设计实验证明固体大部分是NH4Cl时,首先应想到NH4Cl的性质:加热易分解,冷却又化合,故可围绕此性质来设计实验。

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
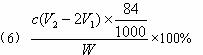


 H4C1等物质
H4C1等物质 溶解度的差异,以食
溶解度的差异,以食 盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳
盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳 酸钙;D:含氨的饱和食盐水、水
酸钙;D:含氨的饱和食盐水、水

 来源:Z|xx|k.Com]
来源:Z|xx|k.Com] 5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。
5)将锥形瓶中的产物过滤后,所得的母液中含有 (以化学式表示),加入氯化氢,并进行 操作,使NaCl溶液循环使用,同时可回收NH4C1。