摘要:25.M转化的物质的量为0.6mol?L-1.则N反应的量也是0.6mol?L-1.所以N的转化率为:×100%=25%. (2)由于该反应的正反应为吸热反应.所以升高温度.化学平衡正向移动.M的转化率增大.
网址:http://m.1010jiajiao.com/timu_id_453385[举报]
硫单质及其化合物在工农业生产中有着重要的应用.

(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
Sx(s)△H=a kJ/mol
2COS(g)+SO2(g)=2CO2(g)+
Sx(s)△H=b kJ/mol.
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 .
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,当生成H3AsO4的物质的量为0.6mol反应中转移电子的数目为 .
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).
①B表示 .
②滴加过程中,溶液中微粒浓度大小关系,正确的是 (填字母).
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为 .
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下所示:

①写出反应器中发生反应的化学方程式是 .
②电渗析装置如图2所示,写出阳极的电极反应式 .该装置中发生的总反应的化学方程式是 .
查看习题详情和答案>>

(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
| 1 |
| x |
2COS(g)+SO2(g)=2CO2(g)+
| 3 |
| x |
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,当生成H3AsO4的物质的量为0.6mol反应中转移电子的数目为
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).
①B表示
②滴加过程中,溶液中微粒浓度大小关系,正确的是
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下所示:

①写出反应器中发生反应的化学方程式是
②电渗析装置如图2所示,写出阳极的电极反应式
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,在自然界主要以钨(+6价)酸盐的形式存在.有开采价值的钨矿石之一黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成FeWO4和MnWO4,钨酸(H2WO4)酸性很弱,难溶于水.碳和金属钨在高温下会反应生成碳化钨.
黑钨矿传统冶炼工艺的第一阶段是碱熔法:
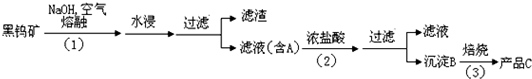
(1)黑钨矿浸入NaOH熔融液过程需通入大量空气,目的是为了使铁和锰转化为氧化物,其中一种红棕色的氧化物化学式为 ;
(2)①已知A的主要成分为Na2WO4,请写出Na2WO4与浓盐酸反应的离子方程式 ;
②上述流程中B、C都是钨的化合物,则步骤(3)中B→C转化属于 ;(填四种基本反应类型之一)
(3)钨冶炼工艺的第二阶段则是用碳、氢气等还原剂把氧化钨(WO3)还原为金属钨.对钨的纯度要求不高时,可用碳作还原剂.写出用碳还原氧化钨制取金属钨的化学方程式: ;为了获得可以拉制灯丝的高纯度金属钨,为什么不宜用碳而必须用氢气作还原剂? .
(4)常温下,黑钨矿中FeWO4和MnWO4的溶度积常数分别为:Ksp(FeWO4)=2.5×10-12;Ksp(MnWO4)=7.5×10-16;欲将体积为1L含MnWO4物质的量为0.6mol悬浊液全部转化为FeWO4悬浊液,理论上可往MnWO4悬浊液加入等体积一定浓度的FeCl2溶液完成上述转化;请计算所加入FeCl2溶液浓度为 mol/L(精确到小数点后一位),所以实际生产过程 (填“能”或“不能”)通过加入FeCl2溶液的方法实现上述转化.(溶液混合体积变化可忽略)
查看习题详情和答案>>
黑钨矿传统冶炼工艺的第一阶段是碱熔法:

(1)黑钨矿浸入NaOH熔融液过程需通入大量空气,目的是为了使铁和锰转化为氧化物,其中一种红棕色的氧化物化学式为
(2)①已知A的主要成分为Na2WO4,请写出Na2WO4与浓盐酸反应的离子方程式
②上述流程中B、C都是钨的化合物,则步骤(3)中B→C转化属于
(3)钨冶炼工艺的第二阶段则是用碳、氢气等还原剂把氧化钨(WO3)还原为金属钨.对钨的纯度要求不高时,可用碳作还原剂.写出用碳还原氧化钨制取金属钨的化学方程式:
(4)常温下,黑钨矿中FeWO4和MnWO4的溶度积常数分别为:Ksp(FeWO4)=2.5×10-12;Ksp(MnWO4)=7.5×10-16;欲将体积为1L含MnWO4物质的量为0.6mol悬浊液全部转化为FeWO4悬浊液,理论上可往MnWO4悬浊液加入等体积一定浓度的FeCl2溶液完成上述转化;请计算所加入FeCl2溶液浓度为
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol.若在该容器中开始时充入2.0molN2和6.0molH2,则平衡时NH3的物质的量为( )
查看习题详情和答案>>
(2013?乐山二模)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量
(2)容器①中反应达平衡时,CO的转化率为
(3)计算容器②中反应的平衡常数K=
(4)下列叙述正确的是
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=
mol/(L?min)
(5)已知:2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)
查看习题详情和答案>>
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
小于
小于
(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.(2)容器①中反应达平衡时,CO的转化率为
80
80
%.(3)计算容器②中反应的平衡常数K=
1
1
.(4)下列叙述正确的是
a
a
(填字母序号).a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=
| 4 |
| Vt1 |
(5)已知:2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol
.(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)
3CO2+5OH-═2CO32-+HCO3-+2H2O
3CO2+5OH-═2CO32-+HCO3-+2H2O
.