题目内容
硫单质及其化合物在工农业生产中有着重要的应用.
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
| 1 |
| x |
2COS(g)+SO2(g)=2CO2(g)+
| 3 |
| x |
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,当生成H3AsO4的物质的量为0.6mol反应中转移电子的数目为
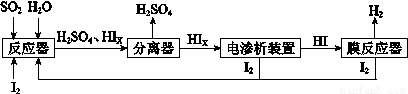
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).
①B表示
②滴加过程中,溶液中微粒浓度大小关系,正确的是
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
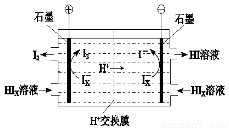
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下所示:

①写出反应器中发生反应的化学方程式是
②电渗析装置如图2所示,写出阳极的电极反应式
分析:(1)根据盖斯定律,利用已知热化学方程式乘以适当的系数进行加减构造出目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
(2)根据化合价的升降以及物质的量的情况来计算转移电子的量;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合图1所示H2S、HS-、S2-的分布分数进行解答;NaHS的含量先增加后减少;根据物料守恒可求得滴加过程中,溶液中微粒浓度大小关系;根据电离平衡和水解规律可得M点时,溶液中各离子浓度大小关系;
(4)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,配平书写方程式;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,阳极区的H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI.
(2)根据化合价的升降以及物质的量的情况来计算转移电子的量;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合图1所示H2S、HS-、S2-的分布分数进行解答;NaHS的含量先增加后减少;根据物料守恒可求得滴加过程中,溶液中微粒浓度大小关系;根据电离平衡和水解规律可得M点时,溶液中各离子浓度大小关系;
(4)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,配平书写方程式;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,阳极区的H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI.
解答:解:(1)①SO2(g)+2CO(g)=2CO2(g)+
Sx(s)△H=a kJ/mol;②2COS(g)+SO2(g)=2CO2(g)+
Sx(s)△H=b kJ/mol,由盖斯定律,0.5x×(②-①)得:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol,
故答案为:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol;
(2)反应As2S3+10HNO3=2H3AsO4+3S+10NO2↑+2H2O中,As元素化合价由As2S3+3价升高到H3AsO4+5价,S元素化合价由As2S3-2价升高到S,0价,若生成2molH3AsO4,则反应中转移电子的物质的量为10mol,若生成0.6molH3AsO4,则反应中转移电子的物质的量为3mol,即3NA,
故答案为:3NA;
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度在减小为Na2S,B先增加后减少为NaHS,C浓度一直在增加为H2S,
故答案为:HS-(或NaHS);
②向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],
故答案为:c;
③A表示Na2S,B为NaHS,当滴加盐酸至M点时,表示两者含量相等,溶液中c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],则c(Na+)>c(HS-),NaHS溶液呈碱性说明其水解大于电离,水解是微弱的所以c(HS-)>c(S2-),硫化钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),则c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+);
(4)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+xI2+2H2O=H2SO4+2HIX,故答案为:SO2+xI2+2H2O=H2SO4+2HIX;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx═(x-1)I2+2HI,故答案为:2Ix--2e-=xI2;2HIx=(x-1)I2+2HI.
| 1 |
| x |
| 3 |
| x |
故答案为:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol;
(2)反应As2S3+10HNO3=2H3AsO4+3S+10NO2↑+2H2O中,As元素化合价由As2S3+3价升高到H3AsO4+5价,S元素化合价由As2S3-2价升高到S,0价,若生成2molH3AsO4,则反应中转移电子的物质的量为10mol,若生成0.6molH3AsO4,则反应中转移电子的物质的量为3mol,即3NA,
故答案为:3NA;
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度在减小为Na2S,B先增加后减少为NaHS,C浓度一直在增加为H2S,
故答案为:HS-(或NaHS);
②向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],
故答案为:c;
③A表示Na2S,B为NaHS,当滴加盐酸至M点时,表示两者含量相等,溶液中c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],则c(Na+)>c(HS-),NaHS溶液呈碱性说明其水解大于电离,水解是微弱的所以c(HS-)>c(S2-),硫化钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),则c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+);
(4)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+xI2+2H2O=H2SO4+2HIX,故答案为:SO2+xI2+2H2O=H2SO4+2HIX;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx═(x-1)I2+2HI,故答案为:2Ix--2e-=xI2;2HIx=(x-1)I2+2HI.
点评:本题以工业上用硫碘开路循环联产氢气和硫酸工艺为载体,考查盖斯定律计算、离子浓度大小比较、电解原理等,侧重于学生的分析能力的考查,为高考常见题型,题目难度中等,注意利用守恒思想比较溶液中微粒浓度大小.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目