摘要:有A.B.C.D.E五种元素.其中A.B.C.D为短周期元素.A元素的周期数.主族数.原子序数相同,B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同,C原子的价电子构型为ns n np n+1.D元素的原子最外层电子数比次外层电子数少2个.D的阴离子与E的阳离子电子层结构相同.D和E可形成化合物E2D. (1)上述元素中.E元素的原子结构示意图为 , D元素的外围电子排布式为 , (2)下列分子结构图中的和表示上述元素的原子中除去最外层电子的剩余部分. 小黑点表示没有形成共价键的最外层电子.短线表示共价键. 则在以上分子中.中心原子采用sp3杂化形成化学键的非极性分子是 , 在③的分子中有 个σ键和 个π键. (3)AgNO3 溶液与足量C的氢化物水溶液反应生成的配合物.其化学式为 .该配合物中心原子通过 杂化方式与配位体以 键相结合.
网址:http://m.1010jiajiao.com/timu_id_4455687[举报]
有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1.试回答:
(1)写出基态D原子的电子排布式
(2)用电子式表示AE2的形成过程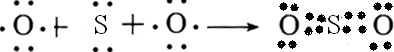
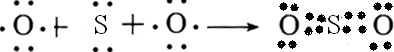 ,与AE2互为等电子体的离子是
,与AE2互为等电子体的离子是
(3)B、C两元素的第一电离能较大的元素是:
(4)根据VSEPR模型预测C的氢化物的立体结构为
(5)C的单质中π键的数目为
查看习题详情和答案>>
(1)写出基态D原子的电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.(2)用电子式表示AE2的形成过程
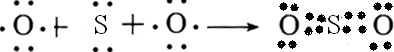
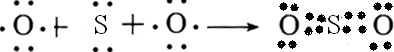
N3-(或CNO-)
N3-(或CNO-)
.(3)B、C两元素的第一电离能较大的元素是:
N
N
(填写元素符号).(4)根据VSEPR模型预测C的氢化物的立体结构为
三角锥形
三角锥形
,中心原子C的轨道杂化类型为sp3
sp3
.(5)C的单质中π键的数目为
2
2
,B、D两元素的气态氢化物的稳定性大小关系为:H2O
H2O
>SiH4
SiH4
(填写化学式).有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级中的电子数等于次外层的电子总数,C原子最外层中有2个不成对的电子.已知C、D、E原子核内的质子数均与中子数相等,且C元素可分别与A、B、D、E生成RC2型化合物,在DC2中,D与C的质量比为7:8,在EC2中,E与C的质量比为1:1.请回答下列问题:
(1)写出A、E两种元素的元素符号:A
(2)写出D原子的电子排布式
(3)指出E在元素周期表中的位置
(4)比较A、B、C三种元素的第一电离能的大小顺序
(5)比较D和E元素的电负性的相对大小
查看习题详情和答案>>
(1)写出A、E两种元素的元素符号:A
C
C
、ES
S
.(2)写出D原子的电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.(3)指出E在元素周期表中的位置
第三周期、第ⅥA族
第三周期、第ⅥA族
.(4)比较A、B、C三种元素的第一电离能的大小顺序
C<O<N
C<O<N
.(5)比较D和E元素的电负性的相对大小
Si<S
Si<S
.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,且原子序数B>C,A原子最外层p能级的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成常见的RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,回答下列问题:
(1)推断五种元素分别是(用元素名称回答):D
(2)指出C元素在元素周期表中的位置
(3)沸点DB2
(4)写出与EB3分子互为等电子体并含A、B、C任意两种元素的微粒
(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,下列是一些键的键能:SiCl4(g)+2H2(g) 高温 Si(s)+4HCl(g) 通过计算该反应是
“放”)
查看习题详情和答案>>
(1)推断五种元素分别是(用元素名称回答):D
硅
硅
,E硫
硫
.(2)指出C元素在元素周期表中的位置
第二周期第ⅤA族
第二周期第ⅤA族
.E元素的最高价氧化物的分子构型为平面三角形
平面三角形
.(3)沸点DB2
>
>
EB2(填“>”、“<”或“=”等于),理由SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2
SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2
(4)写出与EB3分子互为等电子体并含A、B、C任意两种元素的微粒
NO3-
NO3-
(填1种)(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,下列是一些键的键能:SiCl4(g)+2H2(g) 高温 Si(s)+4HCl(g) 通过计算该反应是
吸
吸
热(填“吸”或“放”)
236
236
kJ/mol| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,B原子最外层中有两个未成对的电子,D、E原子核内各自的质子数与中子数相等,B元素可分别与A、C、D、E生成RB2型化合物,并已知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,回答下列问题:
(1)推断五种元素符号分别是:A
(2)写出D原子的电子排布式
(3)指出E元素在元素周期表中的位置
(4)比较A、B、C三种元素的第一电离能的大小顺序
查看习题详情和答案>>
(1)推断五种元素符号分别是:A
C
C
,BO
O
,CN
N
,DSi
Si
,ES
S
.(2)写出D原子的电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.(3)指出E元素在元素周期表中的位置
第三周期第ⅥA族
第三周期第ⅥA族
.(4)比较A、B、C三种元素的第一电离能的大小顺序
N>O>C
N>O>C
(由大到小的顺序排列).有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为 ;D的价电子排布式图为 ;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
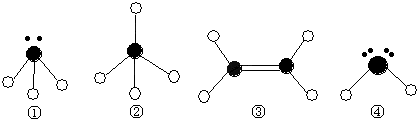
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写分子的化学式); 在③的分子中有 个σ键和 个π键.
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为 ;足量的C的氢化物水溶液与CuSO4 溶液反应生成的配合物,其化学式为 ,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况: .
查看习题详情和答案>>
(1)上述元素中,第一电离能最小的元素的原子结构示意图为
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为