网址:http://m.1010jiajiao.com/timu_id_4426267[举报]
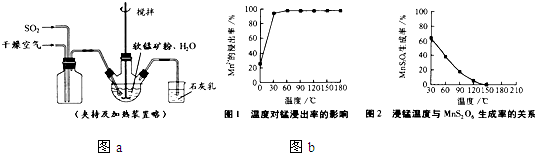
①缓慢向烧瓶中(见图a)通入过量混合气进行“浸锰”操作,主要反应原理为:
SO2+H2O=H2SO3
MnO2+H2SO3=MnSO4+H2O
(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰.
回答:
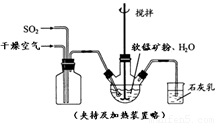
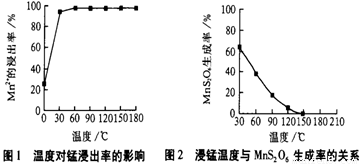
(1)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图b,为减少MnS2O6 的生成,“浸锰”的适宜温度是
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(4)④中加入NH4HCO3后发生反应的离子方程式是
(5)检验④中沉淀是否洗涤干净的方法是
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为:
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
回答:
(1)“浸锰”反应中往往有副产物MnS2O6 的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6 的生成,“浸锰”的适宜温度是 。
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是 。②中加入一定量纯MnO2粉末的主要作用是 ,相应反应的离子方程式为 。
表1:生成相应氢氧化物的pH
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
4.7 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
6.7 |
(3)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4。用平衡移动原理解释加入MnS的作用_________________。
(4)④中加入NH4HCO3 后发生反应的离子方程式是____________________。
(5)检验④中沉淀是否洗涤干净的方法是 。
查看习题详情和答案>>
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为: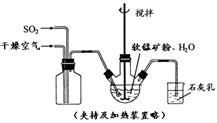
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
回答:
(1)“浸锰”反应中往往有副产物MnS2O6 的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是 。②中加入一定量纯MnO2粉末的主要作用是 ,相应反应的离子方程式为 。
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4。用平衡移动原理解释加入MnS的作用_________________。
(4)④中加入NH4HCO3 后发生反应的离子方程式是____________________。
(5)检验④中沉淀是否洗涤干净的方法是 。 查看习题详情和答案>>
合成氨工业对化学工业和国防工业具有重要意义。设在容积为2.0 L的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
![]() (1) 该条件下反应2NH3(g)
(1) 该条件下反应2NH3(g)![]() N2(g)+ 3H2(g)的平衡常数为 。
N2(g)+ 3H2(g)的平衡常数为 。
![]() (2)相同条件下,在另一相同容器中充入a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mol,H2为2.0 mol,则
(2)相同条件下,在另一相同容器中充入a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mol,H2为2.0 mol,则![]() 。
。
![]() (3)工业上可利用CH4(g)+H2O(g)
(3)工业上可利用CH4(g)+H2O(g)![]() CO(g)+3H2(g)反应生产合成氨原料气H2。已知温度、压强和水碳比[
CO(g)+3H2(g)反应生产合成氨原料气H2。已知温度、压强和水碳比[![]() ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图:
![]()
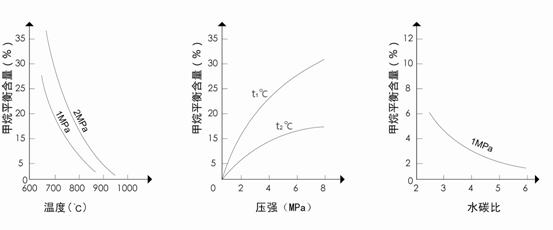
![]() 图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
![]()
![]()
![]() ①降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);
①降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 升高温度,平衡向____________方向移动(选正反应或逆反应)。
升高温度,平衡向____________方向移动(选正反应或逆反应)。
![]() ②图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);
②图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);
![]() 图1中,在800℃、2MPa比1MPa时的甲烷含量_______(选填高、低或不变),
图1中,在800℃、2MPa比1MPa时的甲烷含量_______(选填高、低或不变),
![]()
![]()
![]()
 |
0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/mol?L-1 | 0.100 | a | 0.5b | 0.4b | ||
| c(NO2)/mol?L-1 | 0 | 0.060 | b | c1 | c2 | c3 |
①表中a=
②已知100℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为
,达到平衡时N2O4的转化率为
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H2SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H2SiO4(aq)△H
①写出该反应的化学平衡常数K的表达式:
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响.在一定温度下,在10000m以下的地球深处,上述反应的方向是
| c(H2SiO4) |
| c(SiO2).c2(H2O) |
| c(H2SiO4) |
| c(SiO2).c2(H2O) |