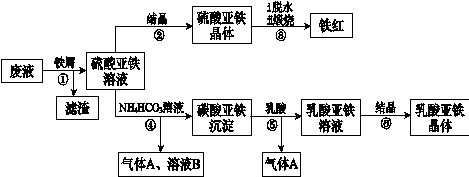
题目内容
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为: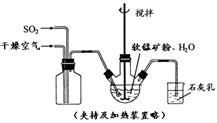
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
回答:
(1)“浸锰”反应中往往有副产物MnS2O6 的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是 。②中加入一定量纯MnO2粉末的主要作用是 ,相应反应的离子方程式为 。
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4。用平衡移动原理解释加入MnS的作用_________________。
(4)④中加入NH4HCO3 后发生反应的离子方程式是____________________。
(5)检验④中沉淀是否洗涤干净的方法是 。
(12分)
(1)150℃ (或150℃以上)(1分)
(2) Fe(OH)3 (1分)
将Fe2+氧化为Fe3+,将过量的SO2氧化除去(2分)
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O , MnO2+SO2 = Mn2+ + SO42- (2分)
(3)MnS(s) Mn2+(aq)+S2-(aq)
Mn2+(aq)+S2-(aq)
生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去。(2分)
(4)Mn2++2HCO3-=MnCO3↓+CO2↑+H2O (2分)
(5)取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净。(2分)(其他答案合理,给分)
解析试题分析:(1)根据图1和图2,150℃以上时,副产物MnS2O6 的生成率低,Mn2+ 的浸出率高,答案:150℃ (或150℃以上)(1分)
(2)pH在2.7到3.5之间时沉淀主要成分是Fe(OH)3 ,答案:Fe(OH)3 1分)
Fe2+ 在pH为7.6到9.6之间沉淀,而此时Mn2+ 也产生沉淀,无法分离,故要将Fe2+ 氧化成Fe3+ 以便在pH小于8.7时沉淀,与Mn2+ 分离,故答案:将Fe2+氧化为Fe3+,将过量的SO2氧化除去(2分)
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O , MnO2+SO2 = Mn2+ + SO42- (2分)
(3)Cu2+ +MnS Mn2++CuS,沉淀的转化,由溶解度较大的MnS转化为溶解度较小的CuS,原理见答案。答案:
Mn2++CuS,沉淀的转化,由溶解度较大的MnS转化为溶解度较小的CuS,原理见答案。答案:
MnS(s) Mn2+(aq)+S2-(aq)
Mn2+(aq)+S2-(aq)
生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去。(2分)
(4)④中加入NH4HCO3 后发生反应的产生MnCO3沉淀,离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O ,答案:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O (2分)
(5)检验④中沉淀是否洗涤干净,就是检验洗涤液中有无SO42―,答案为:取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净。(2分)(其他答案合理,给分)
考点:应用化学反应原理解决化工生产中的实际问题

(1)某工厂每天要烧掉含硫1.6%的烟煤200 t,排放出的SO2会严重污染环境,如果变废为宝,将这些SO2回收利用,那么理论上每年(按365 d计)可生产98%的浓硫酸 吨;
(2)若要在铁制件表面镀镍,则镍应与电源的 极相连,电镀液可以用硫酸镍溶液,电镀过程中硫酸镍溶液的浓度会 (填“增大”“减小”或“不变”);
(3)工业上制造水泥、玻璃时都要用到的原料是 (填编号),用所选原料制玻璃的化学方程式是 ;
| A.纯碱 | B.熟石灰 | C.石灰石 | D.黏土 |
(5)明矾净化水的原理是
(用离子方程式表示);具有暂时硬度的水中除去Mg2+的方法是 、
(用化学方程式表示)。
下列物质不能以食盐为原料而生产的是( )
| A.盐酸 | B.硫酸 | C.烧碱 | D.纯碱 |
对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列说法正确的是( )。
2NH3(g) ΔH<0,下列说法正确的是( )。
| A.达到平衡时反应物和生成物浓度一定相等 |
| B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大 |
| C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动 |
| D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率 |