题目内容
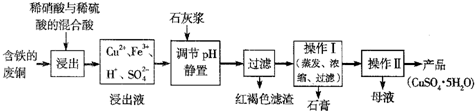
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
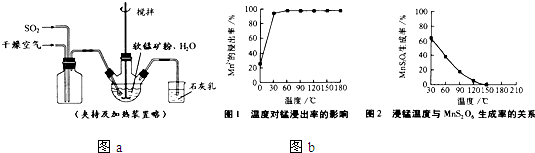
①缓慢向烧瓶中(见图a)通入过量混合气进行“浸锰”操作,主要反应原理为:
SO2+H2O=H2SO3
MnO2+H2SO3=MnSO4+H2O
(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰.
回答:
(1)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图b,为减少MnS2O6 的生成,“浸锰”的适宜温度是 .
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是 .②中加入一定量纯MnO2粉末的主要作用是 ,相应反应的离子方程式为 .
表1:生成相应氢氧化物的pH
(3)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4.用平衡移动原理解释加入MnS的作用 .
(4)④中加入NH4HCO3后发生反应的离子方程式是 .
(5)检验④中沉淀是否洗涤干净的方法是 .
①缓慢向烧瓶中(见图a)通入过量混合气进行“浸锰”操作,主要反应原理为:
SO2+H2O=H2SO3
MnO2+H2SO3=MnSO4+H2O
(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰.

回答:
(1)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图b,为减少MnS2O6 的生成,“浸锰”的适宜温度是
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(4)④中加入NH4HCO3后发生反应的离子方程式是
(5)检验④中沉淀是否洗涤干净的方法是
分析:(1)根据“浸锰”温度与MnS2O6 的生成率的关系图进行解答;
(2)根据表1氢氧化物的pH进行分析解答;二氧化锰有氧化性能分别和亚铁离子、二氧化硫发生氧化还原反应;
(3)根据平衡移动的原理,当生成物的浓度减少时,平衡向正反应方向移动,CuS比MnS更难溶,MnS不断溶解生成更难溶的CuS;
(4))④中加入NH4HCO3后,有浅红色的沉淀生成为碳酸锰,根据质量守恒进行解答;
(5)沉淀会附着SO42-离子,取最后一次洗涤液,用酸化的BaCl2溶液检验是否含有SO42-;
(2)根据表1氢氧化物的pH进行分析解答;二氧化锰有氧化性能分别和亚铁离子、二氧化硫发生氧化还原反应;
(3)根据平衡移动的原理,当生成物的浓度减少时,平衡向正反应方向移动,CuS比MnS更难溶,MnS不断溶解生成更难溶的CuS;
(4))④中加入NH4HCO3后,有浅红色的沉淀生成为碳酸锰,根据质量守恒进行解答;
(5)沉淀会附着SO42-离子,取最后一次洗涤液,用酸化的BaCl2溶液检验是否含有SO42-;
解答:解:(1)根据“浸锰”温度与MnS2O6 的生成率的关系图,当温度150℃以上时,MnS2O6 的生成率几乎为0,所以为减少MnS2O6 的生成,“浸锰”的适宜温度是150℃(或150℃以上),
故答案为:150℃(或150℃以上);
(2)查阅表1,③中调pH为3.5时只有Fe(OH)3开始沉淀,所以沉淀的主要成分是Fe(OH)3;二氧化锰有氧化性,能氧化二价铁离子和二氧化硫,所以②中加入一定量纯MnO2粉末,能将Fe2+氧化为Fe3+,将过量的SO2氧化除去,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,MnO2+SO2=Mn2++SO42-,
故答案为:Fe(OH)3;将Fe2+氧化为Fe3+,将过量的SO2氧化除去;MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,MnO2+SO2=Mn2++SO42-;
(3)③中所得的滤液中含有Cu2+,添加过量的难溶电解质MnS,CuS比MnS更难溶,所以MnS不断溶解,
MnS(S)?Mn2+(aq)+S2-(aq);S2-(aq)+Cu2+(aq)?CuS(S)平衡右移,使Cu2+除去,
故答案为:MnS(S)?Mn2+(aq)+S2-(aq);S2-(aq)+Cu2+(aq)?CuS(S) 生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去;
(4)制备高纯碳酸锰的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,所以④中加入NH4HCO3后发生反应是锰离子和碳酸氢根离子反应,生成碳酸锰和二氧化碳和水,反应方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)沉淀会附着SO42-离子,取最后一次洗涤液,滴加酸化的BaCl2溶液,无沉淀生成,说明已洗净,反之硫酸根离子和钡离子结合生成硫酸钡沉淀,表明未洗干净,有SO42-;
故答案为:取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净;
故答案为:150℃(或150℃以上);
(2)查阅表1,③中调pH为3.5时只有Fe(OH)3开始沉淀,所以沉淀的主要成分是Fe(OH)3;二氧化锰有氧化性,能氧化二价铁离子和二氧化硫,所以②中加入一定量纯MnO2粉末,能将Fe2+氧化为Fe3+,将过量的SO2氧化除去,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,MnO2+SO2=Mn2++SO42-,
故答案为:Fe(OH)3;将Fe2+氧化为Fe3+,将过量的SO2氧化除去;MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,MnO2+SO2=Mn2++SO42-;
(3)③中所得的滤液中含有Cu2+,添加过量的难溶电解质MnS,CuS比MnS更难溶,所以MnS不断溶解,
MnS(S)?Mn2+(aq)+S2-(aq);S2-(aq)+Cu2+(aq)?CuS(S)平衡右移,使Cu2+除去,
故答案为:MnS(S)?Mn2+(aq)+S2-(aq);S2-(aq)+Cu2+(aq)?CuS(S) 生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去;
(4)制备高纯碳酸锰的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,所以④中加入NH4HCO3后发生反应是锰离子和碳酸氢根离子反应,生成碳酸锰和二氧化碳和水,反应方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)沉淀会附着SO42-离子,取最后一次洗涤液,滴加酸化的BaCl2溶液,无沉淀生成,说明已洗净,反之硫酸根离子和钡离子结合生成硫酸钡沉淀,表明未洗干净,有SO42-;
故答案为:取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净;
点评:本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程图,掌握平衡移动原理、理解离子反应的本质是解答的关键,本题实验综合性强,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目