网址:http://m.1010jiajiao.com/timu_id_4425858[举报]
(14分)三苯甲醇( )是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。
)是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。
图1
已知:(1)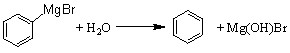 (碱式溴化镁);
(碱式溴化镁);
(2)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7°C | 156.2°C | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6°C | 212.6°C | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
(1)写出装置图中玻璃仪器的名称:A ,导管B的作用 ;
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是 ,微沸回流时冷凝管中水流的方向是
(填“X→Y”或“Y→X”),装有无水CaCl2的仪器A的作用是 ;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写空白:

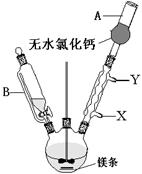
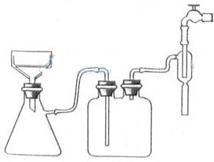
图2 图3
(4)抽滤时所用装置如图3所示,该装置存在的错误有 ,抽滤完毕或中途停止抽滤时的操作方法:应先 ,然后 ;
(5)洗涤液最好选用 ,检验产品已经洗涤干净的操作为 。
(A)水(B)乙醚 (C)乙醇 (D)苯 查看习题详情和答案>>
(14分)三苯甲醇( )是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。
)是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。

图1
已知:(1)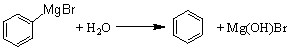 (碱式溴化镁);
(碱式溴化镁);
(2)相关物质的物理性质如下:
|
物质 |
熔点 |
沸点 |
溶解性 |
|
三苯甲醇 |
164.2℃ |
380℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
|
乙醚 |
-116.3℃ |
34.6℃ |
微溶于水,溶于乙醇、苯等有机溶剂 |
|
溴苯 |
-30.7°C |
156.2°C |
不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
|
苯甲酸乙酯 |
-34.6°C |
212.6°C |
不溶于水 |
|
Mg(OH)Br |
常温下为固体 |
能溶于水,不溶于醇、醚等有机溶剂 |
请回答以下问题:
(1)写出装置图中玻璃仪器的名称:A ,导管B的作用 ;
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是 ,微沸回流时冷凝管中水流的方向是
(填“X→Y”或“Y→X”),装有无水CaCl2的仪器A的作用是 ;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写空白:

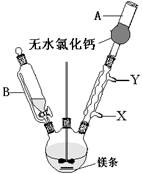
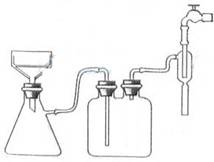
图2 图3
(4)抽滤时所用装置如图3所示,该装置存在的错误有 ,抽滤完毕或中途停止抽滤时的操作方法:应先 ,然后 ;
(5)洗涤液最好选用 ,检验产品已经洗涤干净的操作为 。
(A)水 (B)乙醚 (C)乙醇 (D)苯
查看习题详情和答案>>
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: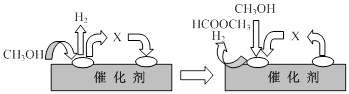
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。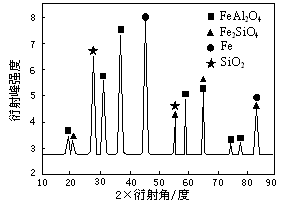
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
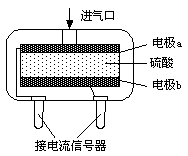
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。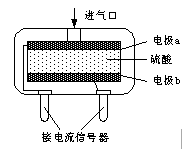
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: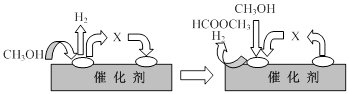
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。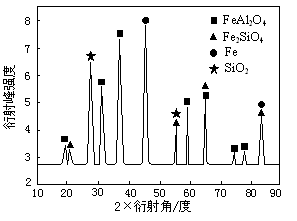
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。