摘要:30.为测定碳酸钙纯度(设含杂质SiO2).学生设计了如下几个实验方案.请回答每个方案中提出的问题. [方案I] (1)称取碳酸钙样品 M g, (2)加入过量盐酸, (3)收集并测定生成的气体体积 V mL. 问题1:反应结束后.量气管中的显示如右图所示.接下来的操作是: .读出甲管中液面的读数. [方案II] (1)称取碳酸钙样品 M g, (2)用c mol/L 盐酸 V mL溶解样品, (3)取溶解后的溶液mL.以酚酞作指示剂.用c′mol/L NaOH溶液滴定.恰好用去V′mL. 问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件.烧杯之外) . 问题3:碳酸钙纯度计算公式 . 问题4:当碳酸钙溶解完全后.少量未溶的SiO2没过滤去.结果得到碳酸钙纯度 [方案Ⅲ](1)称取碳酸钙样品 M g, (2)加入足量c mol/L盐酸V mL使之完全溶解,在滤液中加入过量c′mol/L Na2CO3溶液V′mL,中的沉淀滤出.洗涤.干燥.称重为M′g. 问题5:此方案中不需要的数据是 . A.c.V B.c′. V′ C. M′ D. M 问题6:为减少实验误差.步骤过滤后都要对沉淀进行洗涤.如果步骤(3)未经洗涤.则测定的碳酸钙的纯度将 (偏大.偏小.无影响.下同),如果步骤(5)未经洗涤.则测定的碳酸钠纯度将 . 问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是 .
网址:http://m.1010jiajiao.com/timu_id_4421348[举报]
(满分16分)
某医药研究所开发一种新药,据检测,如果成人按规定的剂量服用,服药后每毫升血液中的含药量为 (微克)与服药后的时间
(微克)与服药后的时间 (小时)之间近似满足如图所示的曲线,其中OA 是线段,曲线 ABC 是函数
(小时)之间近似满足如图所示的曲线,其中OA 是线段,曲线 ABC 是函数 (
( )的图象,且
)的图象,且 是常数.
是常数.

(1)写出服药后y与x的函数关系式;
(2)据测定:每毫升血液中含药量不少于2 微克时治疗疾病有效.若某病人第一次服药时间为早上 6 : 00 ,为了保持疗效,第二次服药最迟应该在当天的几点钟?
(3)若按(2)中的最迟时间服用第二次药,则第二次服药3个小时后,该病人每毫升血液中含药量为多少微克。(结果用根号表示)
查看习题详情和答案>>
本题满分16分)两个数列{an},{bn},满足bn=
.★(参考公式1+22+32+…+n2=
)
求证:{bn}为等差数列的充要条件是{an}为等差数列.
查看习题详情和答案>>
| a1+2a2+3a3+…+nan |
| 1+2+3+…+n |
| n(n+1)(2n+1) |
| 6 |
求证:{bn}为等差数列的充要条件是{an}为等差数列.
甲、乙两位同学都参加了由学校举办的篮球比赛,它们都参加了全部的7场比赛,平均得分均为16分,标准差分别为5.09和3.72,则甲、乙两同学在这次篮球比赛活动中,发挥得更稳定的是( )
查看习题详情和答案>>
 :
: 的离心率为
的离心率为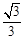 ,直线
,直线 :
: 与椭圆
与椭圆 ,右焦点为
,右焦点为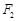 ,直线
,直线 过点
过点 垂直于直线
垂直于直线 ,线段
,线段 的垂直平分线交
的垂直平分线交 ,求点
,求点 的方程.
的方程.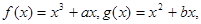
 和
和 是
是 的导函数,若
的导函数,若 在区间I上恒成立,则称
在区间I上恒成立,则称 和
和 在区间I上单调性一致
在区间I上单调性一致 ,若函数
,若函数 上单调性一致,求实数b的取值范围;
上单调性一致,求实数b的取值范围; 且
且 ,若函数
,若函数