网址:http://m.1010jiajiao.com/timu_id_427817[举报]
(14分)在化学反应中,只要物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:2Na+C12 =2NaCl,反应前后,Na元素、Cl元素的化合价分别发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析,下列反应(部分反应条件略去)属于氧化还原反应的是
(填写序号);
①C+O2 == CO2 ②CaO+H2O==Ca(OH)2 ③CaCO3==CaO+CO2↑
④2H2O2 == 2H2O+O2↑ ⑤CO+CuO=Cu+CO2 ⑥HCl+NaOH=NaCl+H2O
(2) 含有高价态元素的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。试回答下列问题:
①该反应的化学方程式可表示为 ;
②向上述反应后的溶液中加入过量的锌粉充分反应后过滤,则滤纸上一定有的固体是
(写化学式,下同),滤液中的溶质是 。
(3) 通过进一步定量分析上述氧化还原反应的化合价变化发现:氧化还原反应中其元素化合价升高总数 (填“大于”、“等于”或“小于”)化合价降低升高总数。氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的F2和烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是_______。 (写化学式)
(4)柠檬果汁中含有维生素C(C6H8O6,简写成Vc)是还原剂,它能被I2氧化生成C6H6O6。当前市场上测定柠檬果汁中Vc含量的方法是取10.00mL果汁,用醋酸酸化,再加入20.00mL 0.02500 mol?dm-3标准碘溶液,然后以淀粉溶液作指示剂,最后用0.01000 mol?dm-3Na2S2O3标准溶液滴定过量的I2,消耗Na2S2O3溶液10.00mL。
①Vc中碳元素的平均化合价是 。
②写出Vc与I2反应的离子方程式。
③此份果汁中含Vc= mg/100mL果汁。
查看习题详情和答案>>
 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.第①步:将硼镁矿用浓碱NaOH溶液溶解,过滤得NaBO2溶液.
第②步:将NaBO2浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7?10H2O.
第③步:将硼砂溶于水后,用H2SO4调节酸度,过滤得H3BO3晶体.
第④步:加热硼酸使之脱水生成氧化物.
第⑤步:脱水产物用镁还原即得粗单质硼.请回答下列问题:
(1)第①步和第⑤步的化学方程式分别为
(2)将制得的粗硼在一定条件下反应全部生成BI3,然后BI3热分解可以得到纯净的单质硼.0.20g粗硼制成的BI3分解得到的I2全部被收集后,用 2.00mol/LNa2S2O3溶液滴定,用去27.00mL Na2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-).
①Na2S2O3溶液成碱性,用离子方程式表达其原因
②粗硼中硼的含量为
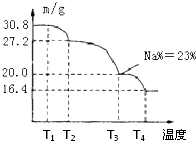
(3)上述制得的硼砂晶体(Na2B4O7?10H2O)还可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.已知纯品过硼酸钠晶体中各元素的物质的量之比为n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如下图所示,则T3时所得晶体的化学式为:

其中,均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;无论是含有D元素还是含有F元素,相邻的乙与丙或丙与丁两两间互不发生化学反应.请回答下列问题:
(1)写出化合物甲的电子式:
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式
(3)复盐是指由2种或2种以上阳离子和一种阴离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐戊的化学式
(4)EC2是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.图2是某啤酒样品不同时间段总EC2的变化情况,请运用所学的知识解释啤酒样品中总EC2随时间变化的主要原因是
(5)由A、C元素组成化合物庚和A、E元素组成的化合物辛,式量均为34.其中庚的熔沸点高于辛,其原因是:
(12分) X、Y、Z、R、Q5种非金属元素的原子序数依次增大,Y、Z、R、Q4种元素位于不同周期且均没有放射性,Y、Z、R形成的单质在通常状况下状态各不相同;XY3为非极性分子,ZR3为极性分子;由Q原子能直接形成熔沸点很低的单质晶体。
(1)甲(化学式为XZ)是一种受到高度关注的耐磨涂料,可用作金属的表面保护层。甲可由XR3和ZR3在氢气中高温反应合成,合成甲的化学反应方程式为:______________________________________________________________;画出XR3分子的结构______________________,指出ZR3分子的空间构型____________________。
(2)用水处理QY2和QY4的混合物,得到气体乙和溶液丙,乙的体积为56.7 mL(标准状况,下同),其中含O2 22.7 mL,余为Q。丙中的QO3能氧化30.0mL浓度为0.100mol/L的(NH4)2Fe(SO4)2。计算混合物中QY2和QY4的物质的量之和为多少?
查看习题详情和答案>>A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:______周期,______族,______区.
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式______;葡萄糖分子中碳原子杂化方式有______.
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于______(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键.
④如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______;该化合物的晶体熔点比干冰高得多,原因是______.
