题目内容
(1)CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是______.
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:______周期,______族,______区.
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式______;葡萄糖分子中碳原子杂化方式有______.
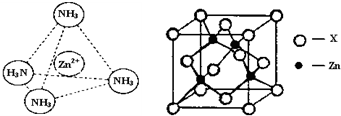
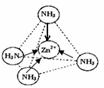
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于______(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键.
④如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______;该化合物的晶体熔点比干冰高得多,原因是______.
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:______周期,______族,______区.
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式______;葡萄糖分子中碳原子杂化方式有______.
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于______(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键.
④如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______;该化合物的晶体熔点比干冰高得多,原因是______.

(1)A.甲烷分子变成CH3+、CH3-、CH3-时,失去的分别是氢负离子、氢离子和质子,空间构型也不再与原来的分子相同,故A错误;
B.CH3+、CH3-、CH3-分别具有6个、7个和8个价电子,不是等电子体,中心碳原子的价层电子对数不同,故空间构型不同,故B错误;
C.CH3-与NH3、H3O+均具有10个电子,互为等电子体,几何构型均为三角锥形,故C正确;
D.CH3+中的碳原子采取sp2杂化,所有原子均共面,故D正确;
E.两个CH3-或一个CH3+和CH3-结合可得到CH3CH3,故E正确.
故选CDE.
(2)①Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期,第ⅡB族ds区,故答案为:四;ⅡB;ds;
②Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10 ,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3;
③配位体NH3分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,是极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,故答案为:极性分子;
;
④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体,而干冰是分子晶体,故该化合物的熔点比干冰高得多,故答案为:ZnX;高,该化合物是原子晶体,而干冰是分子晶体.
B.CH3+、CH3-、CH3-分别具有6个、7个和8个价电子,不是等电子体,中心碳原子的价层电子对数不同,故空间构型不同,故B错误;
C.CH3-与NH3、H3O+均具有10个电子,互为等电子体,几何构型均为三角锥形,故C正确;
D.CH3+中的碳原子采取sp2杂化,所有原子均共面,故D正确;
E.两个CH3-或一个CH3+和CH3-结合可得到CH3CH3,故E正确.
故选CDE.
(2)①Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期,第ⅡB族ds区,故答案为:四;ⅡB;ds;
②Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10 ,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3;
③配位体NH3分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,是极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,故答案为:极性分子;

;
④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体,而干冰是分子晶体,故该化合物的熔点比干冰高得多,故答案为:ZnX;高,该化合物是原子晶体,而干冰是分子晶体.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
如果定义有机物的同系列是一系列结构式符合A?W?B(其中n=0,1,2,3…的化合物.式中A、B是任意一种基团(或氢原子),W为2价有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
| A、CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3 | B、CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3(CH=CH)3CHO | C、CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3 | D、ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3 |
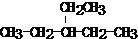
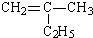
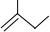

 的结构简式
的结构简式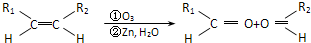
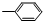 ③-CH═CH2
③-CH═CH2
 +NaOH
+NaOH +NaCl+H2O
+NaCl+H2O