摘要:戴安邦一文(载1989年第1期)
网址:http://m.1010jiajiao.com/timu_id_421118[举报]
1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料.镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的.从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如图:
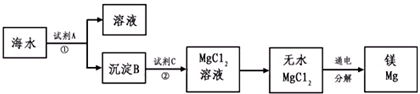
回答下列问题:
(1)Mg在周期表中的位置 ,试剂A可以选用 ,试剂C可选用 ;
(2)步骤①的离子方程式 ;
(3)用电子式表示氯化镁的形成过程 ;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为: ;
(5)戴维制镁的化学方程式为 ;
(6)配平下列反应的方程式.
①UF4+Mg--U+MgF2
②Mg+HNO3--Mg(NO3)2+N2O↑+H2O. 查看习题详情和答案>>

回答下列问题:
(1)Mg在周期表中的位置
(2)步骤①的离子方程式
(3)用电子式表示氯化镁的形成过程
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:
(5)戴维制镁的化学方程式为
(6)配平下列反应的方程式.
①UF4+Mg--U+MgF2
②Mg+HNO3--Mg(NO3)2+N2O↑+H2O. 查看习题详情和答案>>
1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如下:
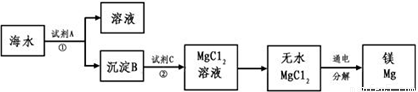
回答下列问题:
(1)Mg在周期表中的位置______________________,试剂A可以选用_____________________,试剂C可选用_______________________;
(2)步骤①的离子方程式_________________________________________;
(3)用电子式表示氯化镁的形成过程_______________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_____________________________________________________;
(5)戴维制镁的化学方程式为_____________________________________;
(6)配平下列反应的方程式。
① 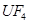 +
+ 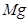 ——
——
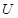 +
+ 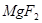
② 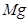 +
+ 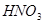 ——
——
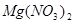 +
+ 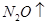 +
+

查看习题详情和答案>>
Ⅰ(1)由于金属钠很容易与空气中的
(2)在实验室里做钠跟水反应的实验时,用到的仪器是
a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵
g.烧杯 h.坩埚 i.石棉网 j.玻璃片 k.药匙 l.燃烧匙
Ⅱ过氧化钠常在在呼吸面具和潜水艇中作为供氧剂.请选择适当的化学试剂和实验用品,用下图中的实验装置进行试验,证明过氧化钠可作供氧剂.

(1)A是制取CO2的装置.写出A中发生反应的化学方程式
(2)填写表中空格:
(3)写出C中发生反应的化学方程式:
(4)试管F中收集满气体后,下一步实验操作是:
查看习题详情和答案>>
氧气
氧气
、水
水
等物质反应,通常将它保存在煤油
煤油
里,如果钠着火,可以用沙子
沙子
灭火.(2)在实验室里做钠跟水反应的实验时,用到的仪器是
bcegj
bcegj
.(填序号)a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵
g.烧杯 h.坩埚 i.石棉网 j.玻璃片 k.药匙 l.燃烧匙
Ⅱ过氧化钠常在在呼吸面具和潜水艇中作为供氧剂.请选择适当的化学试剂和实验用品,用下图中的实验装置进行试验,证明过氧化钠可作供氧剂.

(1)A是制取CO2的装置.写出A中发生反应的化学方程式
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去二氧化碳中的氯化氢 |
| C | ||
| D | NaOH溶液 |
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
.(4)试管F中收集满气体后,下一步实验操作是:
用玻璃片盖住试管口,移出水面,将带火星的木条伸到试管F内,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂
用玻璃片盖住试管口,移出水面,将带火星的木条伸到试管F内,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂
. A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:(1)C在元素周期表中的位置为
(2)F单质的燃烧热△H=-akJ/mol,写出表示F单质的燃烧热的热化学方程式
(3)E单质与D的最高价氧化物的水化物的溶液反应的离子方程式为
(4)A、B两元素可形成离子化合物BA5,其电子式为
(5)将0.4mol FC2和0.2mol C2放入容积为2L的_密闭容器中,在一定条件下发生 反应2FC2+C2?2FC3,当FC2百分含量不变时,得到0.2mol FC3气体,则此时反应的平衡常数K=
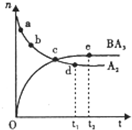
(6)向一绝热恒容密闭容器中通入B2和A2,在一定条件下发生反应B2(g)+3A2(g)?2BA3(g)△H<0,达到平衡,n(A2)和n(BA3)随时间变化的关系如图所示.下列有关叙述一定正确的是
A.c点表示BA3生成速率与BA3分解速率相等
B.c点和e点 A2的转化率相等
C.平衡后再升高温度,不利于BA3的合成
D.d点时:n(A2):n(BA3)=3:2
(7)将E元素的单质(除去氧化膜)投入浓的氯化铜溶液中,在其表面很 快出现一层红色物质,产生气体的速率逐渐加快,经检验,该气体为氢气,用温度计测得溶液的温度迅速升高.请从有关能量、是否有电化学作用等方面,分析能产生氢气且开始 阶段的速率不断加快的原因
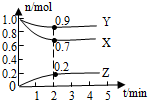 某浓度时,在2L密闭容器中,X.Y.Z三种气体物质的物质的量随时间的变化曲线.如图所示,由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均速率分别为( )
某浓度时,在2L密闭容器中,X.Y.Z三种气体物质的物质的量随时间的变化曲线.如图所示,由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均速率分别为( )