网址:http://m.1010jiajiao.com/timu_id_413747[举报]
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g) = CH4(g)+C2H2(g)(乙炔)+H2(g) △H1=+156.6kJ·mol-1
C3H6(g)(丙烯) = CH4(g)+C2H2(g) (乙炔)△H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)=C3H6(g)(丙烯)+H2(g)的△H= kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程为 ;
放电时,CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1= 。
HCO3-+H+的平衡常数K1= 。
(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
查看习题详情和答案>>(1)F+的价层电子排布为
(2)B、D形成一种超硬、耐磨、耐高温的新型化合物,该化合物化学式为
由氢气与C2反应生成1mol气态H2C产物,放热241.8KJ,若1g 气态H2C转化成液态H2C放热2.444KJ,则反应:2H2(g)+C2(g)=2H2C(L)的△H=
(3)C与氢元素形成的正一价离子含有10电子,该离子中C原子的杂化方式为
(4)1molAC2分子中σ键与π键的数目之比为
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为
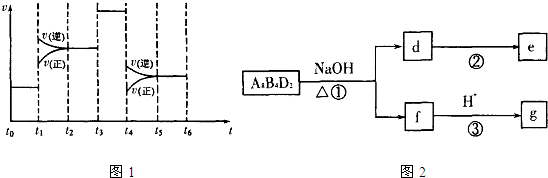
(4)化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图1表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
| 4 |
| a2 |
| 4 |
| a2 |
(5)化合物A8B4D2有如图2转化关系.其中,g是常用调味品的主要成分.写出反应①的化学方程式
| △ |
| △ |
设计实验方案完成d→e的转化
(1)A、D元素按1:1组成的化合物的结构式为
(2)常见化合物W由A、D、E三种元素组成,则W中含有的化学键有
若以W溶液为电解质溶液,铁棒为电极构成电解池,该电解反应的总反应方程式为:
(3)在恒容密闭容器中注入A2、C2两种气体,发生如下反应:3A2(g)+C2(g)?2CA3(g),在某温度下达到平衡时,各物质的浓度分别为:c(A2)=9.00mol/L;(C2)=3.00mol/L,c(CA3)=4.00mol/L.则C2的起始浓度为
(4)A、C、D三种元素按原子个数比4:2:3形成的化合物溶于水,所得溶液呈酸性,用离子方程式解释其原因
(5)用E2D2在酸性条件下处理含CN-的工业废水,将得到N2及CO2等无污染的物质,请写出该反应的离子方程式
 (2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:(1)写出下列各元素的名称:A
(2)上述五种元素中,第一电离能最小的元素是
(3)已知:BA3DA(g)+A2D(g)=BD2(g)+3A2(g)△H1=+49.0kJ/mol,BA3DA(g)+1/2D2(g)=BD2(g)+2A2(g)△H2=-192.9kJ/mol,试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号书写);
| 3 |
| 2 |
| 3 |
| 2 |
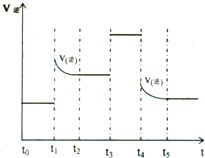
(4)对可逆反应3A2(g)+C2(g)?2CA3(g)当反应达到平衡位置时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
| 4 |
| a2 |
| 4 |
| a2 |