题目内容
 (2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:(1)写出下列各元素的名称:A
氢
氢
D氧
氧
(2)上述五种元素中,第一电离能最小的元素是
Na
Na
,基态原子未成对电子数最多的原子核外电子排布式为1s22s22p3
1s22s22p3
.(3)已知:BA3DA(g)+A2D(g)=BD2(g)+3A2(g)△H1=+49.0kJ/mol,BA3DA(g)+1/2D2(g)=BD2(g)+2A2(g)△H2=-192.9kJ/mol,试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号书写);
CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-676.7kJ/mol
| 3 |
| 2 |
CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-676.7kJ/mol
| 3 |
| 2 |
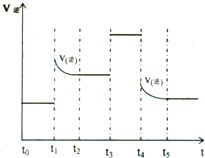
(4)对可逆反应3A2(g)+C2(g)?2CA3(g)当反应达到平衡位置时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
t0-t1
t0-t1
.在一定温度下,若将4amol A2和2a mol C2放入lL的密闭容器中,充分反应后测得C2的转化率为50%,则该反应的平衡常数为| 4 |
| a2 |
| 4 |
| a2 |
正
正
(“正”“逆”或“不移动”).分析:A原子半径最小,则A为H元素;B元素原子的最外层电子数是内层电子数的2倍,则B为C元素;C元素原子的电子层数为n,最外层电子数为2n+1,当n为2时,C为N元素,当n为3时,C为Cl元素,根据题意C不能为Cl,否则E就不是短周期元素,所以C为N元素;A、E同主族,所以E为Na元素;A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物,则D为O元素.
(1)按要求写元素名称即可;
(2)根据电离能变化规律考虑,按要求写电子排布式;
(3)根据盖斯定律写热化学方程式;
(4)分析图象,利用三段式计算平衡浓度,进而计算平衡常数和利用平衡移动原理判断反应方向.
(1)按要求写元素名称即可;
(2)根据电离能变化规律考虑,按要求写电子排布式;
(3)根据盖斯定律写热化学方程式;
(4)分析图象,利用三段式计算平衡浓度,进而计算平衡常数和利用平衡移动原理判断反应方向.
解答:解:A原子半径最小,则A为H元素;B元素原子的最外层电子数是内层电子数的2倍,则B为C元素;C元素原子的电子层数为n,最外层电子数为2n+1,当n为2时,C为N元素,当n为3时,C为Cl元素,根据题意C不能为Cl,否则E就不是短周期元素,所以C为N元素;A、E同主族,所以E为Na元素;A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物,则D为O元素.
(1)由以上推断可知A为H元素,D为O元素,按要求写元素名称为:氢 氧,故答案为:氢 氧;
(2)根据第一电离能变化规律,周期表中,同周期从左到右,电离能逐渐增大,同主族从上到下,第一电离能逐渐减小,所以这五种元素中钠的第一电离能最小.
H、C、N、O、Na这五种元素的未成对电子依次为:1、2、3、2、1,N元素的未成对电子数最多,电子排布式为:1s22s22p3.故答案为:Na 1s22s22p3;
(3)把字母换成具体元素得:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ?mol-1
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g);△H=-192.9kJ?mol-1
根据盖斯定律将②×3-①×2可得:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)
△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,
故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-676.7kJ/mol;
(4)从图象可看出,改变条件平衡一直向逆反应方向移动,故t0-t1 NH3含量最高.
3H2+N2=2NH3
起始浓度(mol/L) 4 a 2a 0
转化浓度(mol/L) 3a a 2a
平衡浓度(mol/L) a a 2a
K=
=
.若此时再向该容器中投入a mol A2,a mol C2和2a mol CA3时,
相当于加压,平衡向体积减少方向即正向移动.故答案为:t0-t1
正.
(1)由以上推断可知A为H元素,D为O元素,按要求写元素名称为:氢 氧,故答案为:氢 氧;
(2)根据第一电离能变化规律,周期表中,同周期从左到右,电离能逐渐增大,同主族从上到下,第一电离能逐渐减小,所以这五种元素中钠的第一电离能最小.
H、C、N、O、Na这五种元素的未成对电子依次为:1、2、3、2、1,N元素的未成对电子数最多,电子排布式为:1s22s22p3.故答案为:Na 1s22s22p3;
(3)把字母换成具体元素得:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ?mol-1
②CH3OH(g)+
| 1 |
| 2 |
根据盖斯定律将②×3-①×2可得:CH3OH(g)+
| 3 |
| 2 |
△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,
故答案为:CH3OH(g)+
| 3 |
| 2 |
(4)从图象可看出,改变条件平衡一直向逆反应方向移动,故t0-t1 NH3含量最高.
3H2+N2=2NH3
起始浓度(mol/L) 4 a 2a 0
转化浓度(mol/L) 3a a 2a
平衡浓度(mol/L) a a 2a
K=
| (2a)2 |
| a×a3 |
| 4 |
| a2 |
相当于加压,平衡向体积减少方向即正向移动.故答案为:t0-t1
| 4 |
| a2 |
点评:本题综合性较强,但推断元素是关键.在判断氨的含量时,一定要看反应方向,而不是看速率大小.

练习册系列答案
相关题目