网址:http://m.1010jiajiao.com/timu_id_408343[举报]
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
B
B
A
D
C
C
A
D
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
C
C
CD
BD
D
BC
B
BD
AC
三、(本题包括3小题,共34分)
19.(11分)
(1)CO32- + H2O
 HCO3- + OH- (2分)(配平、化学式错得0分,写等号扣1分)
HCO3- + OH- (2分)(配平、化学式错得0分,写等号扣1分)
(2)不再有气泡产生(或只有极少量气泡产生) (1分)
(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全 (2分)
(两个方面各占1分)
(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (2分) (化学式错得0分,配平错扣1分)
(5)6.6 (2分) (多写单位g不扣分)
(6)循环使用 (2分)(具体说出如何循环使用同样得分,意思相近表达欠清晰扣1分)
20.(11分)
(1)2MnO4- + 5H
(化学式错得0分,配平错扣1分,漏↑扣1分,扣完为止)
(2)4 (2分)
(3)① 反应开始时:c(KMnO4)= =0.00067 mol?L-1 (1分)
=0.00067 mol?L-1 (1分)
反应时间: =
= =6.7min (1分)
=6.7min (1分)
KMnO4的平均反应速率:
ν(KMnO4)= =
= =1×10-4 mol?L-1?min-1 (1分)
=1×10-4 mol?L-1?min-1 (1分)
(一步完成计算且结果正确得3分,结果错误得0分。速率单位错误扣1分)
② 否(或:不可行) (1分) 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。(3分)
(基本思路错误得0分,思路正确未强调草酸过量扣1分,未强调体积相同扣1分)
21.(12分)
(1)7 (1分)
实验操作
预期现象和结论
步骤1:用药匙取少量白色粉末于试管A底部,点燃酒精灯,充分加热试管。
(1分)
白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl。(2分)
步骤2:用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡。(1分)
固体溶解得无色溶液。(1分)
步骤3:向试管B中滴加过量的 Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置。(2分)
有白色沉淀生成,证明原白色粉末含有 K2SO4。(1分)
步骤4:取试管B中上层清液少量于试管C中,滴加 AgNO3溶液和1mol?L-1硝酸。(2分)
有白色沉淀生成,证明原白色粉末含有NaCl。(1分)
(3)
(NH4Cl的检验用NaOH溶液和红色石蕊试纸同样得3分;另取样品溶于水进行K2SO4的检验同样得2分;NaCl的检验必须包含有上述4个步骤的操作,共6分(着重号为关键点);步骤设计不合理,次序混乱酌情扣分。)
四、(本题包括3小题,共34分)
22.(10分)
(1)①  (1分)
(1分)
② 取形状大小相同的镁片和铝片分别与体积相同、浓度相同的稀盐酸反应,观察产生气泡的快慢 (2分)(操作1分,观察指标1分。着重号部分缺一处扣1分。用金属与沸水反应、等浓度盐溶液碱性比较等合理方法均得分,方案无可行性不给分。)
③ Na2SO3 + SO2 + H2O = 2NaHSO3 (2分)(化学式错得0分,配平错扣1分)
有白色胶状沉淀生成,有无色刺激性气味气体产生 (2分)
(各占1分,着重号部分有缺漏合扣1分)
(2)① H2PO4-、HCO3-、HPO42- (2分) ② 强 (1分)
23.(12分)
(1)Ba2+ + SO42- = BaSO4↓ Mg2+ + 2OH- = Mg(OH)2↓
Ca2+ + CO32- = CaCO3↓ Ba2+ + CO32- = BaCO3↓ (4分)
(每个1分。符号错误、漏↓得0分)
(2)2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑ (2分)
2NaOH + H2↑+ Cl2↑ (2分)
(化学式错得0分,配平错扣1分,漏↑扣1分,漏条件扣1分,扣完为止)
(3)制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种) (2分)
(写对1个得1分。答案多于2个的按前2个答案评分。)
(4)蒸发浓缩(1分) 过滤(1分) (多写冷却不得分也不扣分)
蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解) (2分)
(两个因素各占1分。后者从溶度积角度作答叙述正确也给分。)
24.(12分)
(1)增大 (1分)
(2)向左移 (1分)
 (3)(4分)
(3)(4分)
(各占2分,起点位置、曲线走势、终点与原曲线的相对高低等只要有一处错误则得0分。)
(4)(4分)
0.60(2分)
ν正_>_ν逆(2分)
(5)-787.0 (2分)(不带负号得0分,有效数字不准确扣1分。)
五、(本题包括1小题,共9分)
 25.(9分)
25.(9分)
(1) (2分)(有错即得0分)
 |
(2分)(漏系数n扣1分,漏条件不扣分)
 |
(2) (2分)

(3) (2分)
(漏系数2扣1分,不写条件不扣分)
(4)A、B (2分) (漏选1个扣1分,多选一个也扣1分,扣完为止。)
六、选做题(本题包括2小题,每小题10分。考生只能选做一题)
26.(10分)
 (1)① 碳碳双键、羧基 (2分)(写对一种得1分,错别字不给分,多写一个扣1分)
(1)① 碳碳双键、羧基 (2分)(写对一种得1分,错别字不给分,多写一个扣1分)
② (3分)
(2) (5分)

 (1分)
(1分)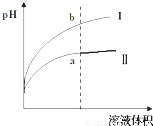
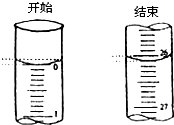 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白: