题目内容
 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)该学生的实验操作如下:
A.用碱式滴定管取待测NaOH溶液25.00mL,注入锥形瓶中,加入2滴酚酞.
B.用待测定的溶液润洗碱式滴定管
C.用蒸馏水洗干净滴定管
D.取下酸式滴定管用标准液的润洗后,将标准液注入酸式滴定管刻度“0”以上2-3cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作2次
G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
滴定操作的正确顺序是(用序号填写)E→
C
C
→D→B
B
→A
A
→G
G
→F;(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
锥形瓶内溶液的颜色变化
锥形瓶内溶液的颜色变化
_.直到因加入一滴盐酸后,溶液由红色变为无色,并且浅红色变为无色且半分钟内不褪色
浅红色变为无色且半分钟内不褪色
为止;(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
D
D
;A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
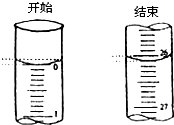
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为
0.00
0.00
mL,终点读数26.10
26.10
mL;(5)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
0.1044mol/L
0.1044mol/L
.(6)有一学生在实验室测某碱溶液的pH.实验时,他先用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测.
①该学生的操作是
错误
错误
(正确或错误).②如不正确,请分析是否一定有误差,为什么?
溶液被稀释氢离子或氢氧根离子浓度发生了变化
溶液被稀释氢离子或氢氧根离子浓度发生了变化
.③若用此法分别测定c(H+)相同的盐酸和醋酸的稀溶液的pH,误差较大的是
盐酸
盐酸
,原因是盐酸是强酸酸稀释时pH值变化大,醋酸是弱酸稀释时电离平衡正向移动,pH值变化小;
盐酸是强酸酸稀释时pH值变化大,醋酸是弱酸稀释时电离平衡正向移动,pH值变化小;
.分析:(1)根据中和滴定有检漏、洗涤、润洗、装液、滴定等操作;
(2)根据酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由浅红色变为无色,且半分钟内不变色;
(3)根据c(待测)=
,分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)根据滴定管的结构和精确度以及测量的原理.
(5)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出C(NaOH);
(6)①用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.
②用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测,相当于稀释了试样,使溶液的碱性减弱;
③醋酸是弱电解质,在水溶液里存在电离平衡,氯化氢是强电解质,不存在电离平衡,所以向等pH的盐酸和醋酸中加水稀释,能促进醋酸电离,根据溶液中氢离子浓度判断其pH的关系;
(2)根据酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由浅红色变为无色,且半分钟内不变色;
(3)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(4)根据滴定管的结构和精确度以及测量的原理.
(5)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出C(NaOH);
(6)①用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.
②用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测,相当于稀释了试样,使溶液的碱性减弱;
③醋酸是弱电解质,在水溶液里存在电离平衡,氯化氢是强电解质,不存在电离平衡,所以向等pH的盐酸和醋酸中加水稀释,能促进醋酸电离,根据溶液中氢离子浓度判断其pH的关系;
解答:解:(1)中和滴定按照检漏、洗涤、润洗、装液、滴定等顺序操作,故答案为:ECDBAGF;
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定时,当溶液颜色由浅红色变为无色,且半分钟内不变色,可说明达到滴定终点,
故答案为:锥形瓶内溶液的颜色变化;浅红色变为无色且半分钟内不褪色;
(3)A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
,可知c(待测)偏大,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,造成V(标准)不变,根据c(待测)=
,可知c(待测)不变,故A错误;
C、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
,可知c(待测)偏大,故C错误;
D、读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=
,可知c(待测)偏小,故D正确;
故选:D;
(4)起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL,
故答案为:0.00;26.10;
(5)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=26.10mL,
HCl+NaOH=NaCl+H2O
0.0261L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=
=0.1044mol/L;
故答案为:0.1044mol/L;
(6)①用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,用蒸馏水润湿pH试纸,相当于稀释了试样,使溶液的碱性减弱,测定结果不准确,故答案为:错误;
②用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测,稀释了试样,使溶液的碱性减弱,测定结果不准确,
故答案为:溶液被稀释氢离子或氢氧根离子浓度发生了变化;
③醋酸是弱电解质,氯化氢是强电解质,因为醋酸中存在电离平衡,盐酸中不存在电离平衡,加水稀释促进醋酸电离,所以加等体积的水稀释等pH的醋酸和盐酸,稀释后的醋酸溶液中C(H+)大于盐酸溶液中C(H+),pH值变化小;
故答案为:盐酸;盐酸是强酸酸稀释时pH值变化大,醋酸是弱酸稀释时电离平衡正向移动,pH值变化小;
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定时,当溶液颜色由浅红色变为无色,且半分钟内不变色,可说明达到滴定终点,
故答案为:锥形瓶内溶液的颜色变化;浅红色变为无色且半分钟内不褪色;
(3)A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,造成V(标准)不变,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
C、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
D、读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故选:D;
(4)起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL,
故答案为:0.00;26.10;
(5)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=26.10mL,
HCl+NaOH=NaCl+H2O
0.0261L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=
| 0.0261L×0.1000mol/L |
| 0.025L |
故答案为:0.1044mol/L;
(6)①用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,用蒸馏水润湿pH试纸,相当于稀释了试样,使溶液的碱性减弱,测定结果不准确,故答案为:错误;
②用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测,稀释了试样,使溶液的碱性减弱,测定结果不准确,
故答案为:溶液被稀释氢离子或氢氧根离子浓度发生了变化;
③醋酸是弱电解质,氯化氢是强电解质,因为醋酸中存在电离平衡,盐酸中不存在电离平衡,加水稀释促进醋酸电离,所以加等体积的水稀释等pH的醋酸和盐酸,稀释后的醋酸溶液中C(H+)大于盐酸溶液中C(H+),pH值变化小;
故答案为:盐酸;盐酸是强酸酸稀释时pH值变化大,醋酸是弱酸稀释时电离平衡正向移动,pH值变化小;
点评:本题主要考查了中和滴定操作、误差分析、化学计算以及弱电解质的稀释,难度不大,根据课本知识即可完成.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白: 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白: 某学生欲用已知物质的量浓度为1.00mol/L盐酸来测定未知物质的量浓度的NaOH溶液20.00mL,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度为1.00mol/L盐酸来测定未知物质的量浓度的NaOH溶液20.00mL,选择甲基橙作指示剂.请填写下列空白: 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白: