题目内容
下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液I、属于非电解质的是______;(填序号)
Ⅱ、(1)NaHCO3是一种______(填“强”或“弱”)电解质;
(2)写出HCO3-水解的离子方程式:______;
(3)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH- 五种微粒的浓度由大到小的顺序为:______.
(4)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K1=______.(已知:10-5.60=2.5×10-6)
Ⅲ、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
(1)该Ba(OH)2溶液的物质的量浓度为______;
(2)溶液中由水电离出c(OH-)=______;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=______.
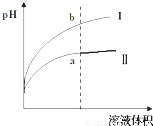
Ⅳ、醋酸是一种弱电解质.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.则图______(填“I”或“Ⅱ”)为醋酸稀释的图象.
【答案】分析:I、在水溶液里和熔融状态下都不导电的化合物是非电解质;
Ⅱ、(1)完全电离的电解质是强电解质,强酸、强碱和大多数盐是强电解质;
(2)碳酸氢根离子水解生成碳酸和氢氧根离子;
(3)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,说明碳酸氢根离子的水解程度电离电离程度,钠离子不水解,碳酸氢根离子水解程度较弱;
(4)H2CO3?HCO3-+H+的平衡常数K1=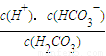 ;
;
Ⅲ、(1)Ba(OH)2溶液的物质的量浓度等于氢离子浓度的一半;
(2)水电离出c(OH-)=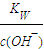 ;
;
(3)pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,假定体积分别为1L、9L,所得溶液pH=11,即混合后溶液中c(OH -)=10-3mol/L,令盐酸的浓度为amol/L,用a表示出混合后溶液中n(OH -),列方程计算;
Ⅳ、盐酸是强电解质,醋酸是弱电解质,相同pH值的盐酸和醋酸溶液分别加水稀释,醋酸稀释促进醋酸电离继续产生氢离子,故稀释相同的倍数,醋酸的pH增大的较小.
解答:解:Ⅰ、①Cu是金属单质能导电,但单质即不是电解质也不是非电解质;
②液态SO2是共价化合物不能导电,不是电解质,属于非电解质;
③纯醋酸溶于水能导电,是电解质;
④NaHCO3是离子化合物,是电解质;
⑤Ba(OH)2溶液是混合物,即不是电解质也不是非电解质.
故选:②;
Ⅱ、(1)NaHCO3属于盐,在水溶液中完全电离,属于强电解质,故答案为:强;
(2)HCO3-水解生成碳酸与氢氧根离子,水解离子方程式为HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-+H2O?H2CO3+OH-;
(3)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);
Ⅲ、(1)pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,根据氢氧根守恒可知,溶液中c[Ba(OH)2]= c(OH-)=0.5×0.1mol/L=0.05mol/L,
c(OH-)=0.5×0.1mol/L=0.05mol/L,
故答案为:0.05mol/L;
(2)pH=13的Ba(OH)2溶液中氢离子使由水电离产生的,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-13mol/L,
故答案为:10-13mol/L;
(3)pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,假定体积分别为1L、9L,所得溶液pH=11,即混合后溶液中c(OH -)=10-3mol/L,令盐酸的浓度为amol/L,则混合后溶液中n(OH -)=1L×0.1mol/L-9L×amol/L=10-3mol/L×(1L+9L),解得a=0.01,则溶液的pH=2,
故答案为:2;
Ⅳ、盐酸是强电解质,醋酸是弱电解质,相同pH值的盐酸和醋酸溶液分别加水稀释,醋酸稀释促进醋酸电离继续产生氢离子,故稀释相同的倍数,醋酸的PH增大的较小,故图Ⅱ为醋酸稀释的图象,
故答案为:Ⅱ.
点评:本题考查电解质、溶液PH的有关计算、盐类水解与离子浓度的大小比较、弱电解质的电离等,综合性较大,难度中等,是对知识的综合运用,需要学生具有扎实的基础知识.
Ⅱ、(1)完全电离的电解质是强电解质,强酸、强碱和大多数盐是强电解质;
(2)碳酸氢根离子水解生成碳酸和氢氧根离子;
(3)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,说明碳酸氢根离子的水解程度电离电离程度,钠离子不水解,碳酸氢根离子水解程度较弱;
(4)H2CO3?HCO3-+H+的平衡常数K1=
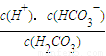 ;
;Ⅲ、(1)Ba(OH)2溶液的物质的量浓度等于氢离子浓度的一半;
(2)水电离出c(OH-)=
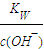 ;
;(3)pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,假定体积分别为1L、9L,所得溶液pH=11,即混合后溶液中c(OH -)=10-3mol/L,令盐酸的浓度为amol/L,用a表示出混合后溶液中n(OH -),列方程计算;
Ⅳ、盐酸是强电解质,醋酸是弱电解质,相同pH值的盐酸和醋酸溶液分别加水稀释,醋酸稀释促进醋酸电离继续产生氢离子,故稀释相同的倍数,醋酸的pH增大的较小.
解答:解:Ⅰ、①Cu是金属单质能导电,但单质即不是电解质也不是非电解质;
②液态SO2是共价化合物不能导电,不是电解质,属于非电解质;
③纯醋酸溶于水能导电,是电解质;
④NaHCO3是离子化合物,是电解质;
⑤Ba(OH)2溶液是混合物,即不是电解质也不是非电解质.
故选:②;
Ⅱ、(1)NaHCO3属于盐,在水溶液中完全电离,属于强电解质,故答案为:强;
(2)HCO3-水解生成碳酸与氢氧根离子,水解离子方程式为HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-+H2O?H2CO3+OH-;
(3)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);
Ⅲ、(1)pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,根据氢氧根守恒可知,溶液中c[Ba(OH)2]=
 c(OH-)=0.5×0.1mol/L=0.05mol/L,
c(OH-)=0.5×0.1mol/L=0.05mol/L,故答案为:0.05mol/L;
(2)pH=13的Ba(OH)2溶液中氢离子使由水电离产生的,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-13mol/L,
故答案为:10-13mol/L;
(3)pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,假定体积分别为1L、9L,所得溶液pH=11,即混合后溶液中c(OH -)=10-3mol/L,令盐酸的浓度为amol/L,则混合后溶液中n(OH -)=1L×0.1mol/L-9L×amol/L=10-3mol/L×(1L+9L),解得a=0.01,则溶液的pH=2,
故答案为:2;
Ⅳ、盐酸是强电解质,醋酸是弱电解质,相同pH值的盐酸和醋酸溶液分别加水稀释,醋酸稀释促进醋酸电离继续产生氢离子,故稀释相同的倍数,醋酸的PH增大的较小,故图Ⅱ为醋酸稀释的图象,
故答案为:Ⅱ.
点评:本题考查电解质、溶液PH的有关计算、盐类水解与离子浓度的大小比较、弱电解质的电离等,综合性较大,难度中等,是对知识的综合运用,需要学生具有扎实的基础知识.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
 下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液 H2CO3+OH-
H2CO3+OH- 下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液 HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)