摘要:x 4-3.6=0.4
网址:http://m.1010jiajiao.com/timu_id_403872[举报]
X、Y、Z和W为原子序数依次增大的短周期元素,X是空气中含量最高的元素,Y 和Z同主族,Z和W的气态氢化物具有相同的电子数,Y的单质只有氧化性.
(1)写出Z的气态氢化物的结构式
 .
.
(2)写出用惰性电极电解Cu(XY3)2溶液的离子反应方程式
(3)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究ZY2和W2的性质.
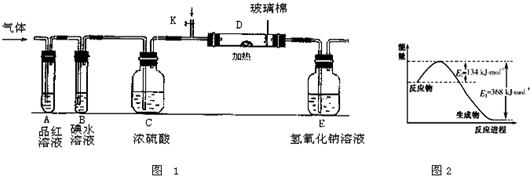
①分别通入ZY2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移的电子为5.0×10-5mol,则该反应的化学方程式为
(4)某同学将足量的ZY2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(5)图2是1molXO2和1molCO反应生成CO2和XO过程中能量变化示意图,请写出XO2和CO反应的热化学方程式
(6)盐酸肼(X2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与XH4Cl类似.
写出盐酸肼第一步水解反应的离子方程式
查看习题详情和答案>>
(1)写出Z的气态氢化物的结构式
H-S-H
H-S-H
,与W同周期惰性气体元素的原子结构示意图

(2)写出用惰性电极电解Cu(XY3)2溶液的离子反应方程式
2Cu2++2H2O
2Cu+4H++O2↑
| ||
2Cu2++2H2O
2Cu+4H++O2↑
.
| ||
(3)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究ZY2和W2的性质.

①分别通入ZY2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)
相同
相同
;②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移的电子为5.0×10-5mol,则该反应的化学方程式为
5Cl2+I2+6H2O=2HIO3+10HCl
5Cl2+I2+6H2O=2HIO3+10HCl
.(4)某同学将足量的ZY2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)
AC
AC
,可以看到白色沉淀生成,其原因为:当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀)
当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀)
(写出其中一种即可).A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(5)图2是1molXO2和1molCO反应生成CO2和XO过程中能量变化示意图,请写出XO2和CO反应的热化学方程式
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1
.(6)盐酸肼(X2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与XH4Cl类似.
写出盐酸肼第一步水解反应的离子方程式
N2H62++H2O?[N2H5?H2O]++H+
N2H62++H2O?[N2H5?H2O]++H+
.X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨.请回答:
(1)写出XY2分子的电子式
 .
.
(2)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为
工业制造W的生产过程主要分为三个阶段.
①在 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择的适合的温度和压强是
A.400℃~500℃10MPa
B.400℃~500℃1MPa
C.500℃~500℃10MPa
D.400℃~500℃0.1MPa
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(3)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是
查看习题详情和答案>>
(1)写出XY2分子的电子式


(2)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为
H2SO4
H2SO4
.工业制造W的生产过程主要分为三个阶段.
①在 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式
S(s)+O2(g)=SO2(g);△H=-297kJ?mol-1;
S(s)+O2(g)=SO2(g);△H=-297kJ?mol-1;
.②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择的适合的温度和压强是
B
B
(选填字母).A.400℃~500℃10MPa
B.400℃~500℃1MPa
C.500℃~500℃10MPa
D.400℃~500℃0.1MPa
| 压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
C
C
.A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(3)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是
SO2+2CO
S+2CO2
| ||
| △ |
SO2+2CO
S+2CO2
.
| ||
| △ |
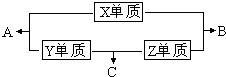 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个.而M的单质在常温常压下为固体,并且M元素是形成化合物种类最多的元素.请回答下列问题:
(1)元素X在周期表中的位置
第2周期第ⅥA族
第2周期第ⅥA族
.(2)化合物C在一定条件下生成化合物A的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,得到pH=5的溶液,反应后的溶液存在的平衡体系有
NH4++H2O?NH3?H2O+H+;H2O?OH-+H+;
NH4++H2O?NH3?H2O+H+;H2O?OH-+H+;
;溶液中离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.(4)实验室里为制取C,常在C的浓溶液中加入生石灰.请叙述产生C的原因
氧化钙溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧化钙吸水,促使氨放出;生成的氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
氧化钙溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧化钙吸水,促使氨放出;生成的氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
.(5)已知Y单质和Z单质生成C的反应是可逆反应,△H<0.将等物质的量的单质Y和单质Z充入一密闭容器中,在适当催化剂和恒温条件下反应.下列说法中正确的是
ab
ab
a.达到化学平衡时,正反应与逆反应速率相等
b.反应过程中,单质Y的体积分数始终为50%
c.达到化学平衡时,Y单质和Z单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡时,再升高温度,C的体积分数增大
(6)由X、Z、M三种元素可以形成化合物M2Z6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则发生的有关化学方程式为
CH3CH2OH+CuO
CH2CHO+Cu+H2O
| 加热 |
CH3CH2OH+CuO
CH2CHO+Cu+H2O
.| 加热 |
X、Y是元素周期表前20号元素,且X的原子序数比Y大4.请填空:
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂.
(1)元素Y的原子结构示意图为 .
(2)含X的某盐与Y的气态氧化物都能作漂白剂,实验室保存该盐的方法是 .
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小.
(3)乙烯与X单质反应的反应类型为 .
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入X、Y形成的一种常见化合物,该化合物的作用是 (用必要的离子方程式和文字解释).
Ⅲ.若X是短周期最活泼的金属元素.
(5)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 .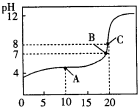
(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①A、B、C三点所示溶液导电能力由强到弱顺序为 .
②估算25℃时HA的电离常数为 .
查看习题详情和答案>>
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂.
(1)元素Y的原子结构示意图为
(2)含X的某盐与Y的气态氧化物都能作漂白剂,实验室保存该盐的方法是
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小.
(3)乙烯与X单质反应的反应类型为
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入X、Y形成的一种常见化合物,该化合物的作用是
Ⅲ.若X是短周期最活泼的金属元素.
(5)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为

(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①A、B、C三点所示溶液导电能力由强到弱顺序为
②估算25℃时HA的电离常数为
X、Y、Z、Q,W五种短周期元素原子序数依次增大.化合物甲由X、Z、Q三种元素组成,常温下,0.01mol/L甲溶液的pH=12,工业上常用电解QW饱和溶液生产甲.请填写下列空白.
(1)Q的离子结构示意图为 .
(2)工业电解QW饱和溶液时,阳极电极反应式为 .
(3)常温下,往甲溶液中通入一定量W的单质,充分反应后,得到溶液乙.
①将溶液乙滴在红色石蕊试纸上,可观察到现象是试纸先变蓝后褪色,其褪色原因是:
②溶液乙中某种溶质与Fe(OH)3在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
(4)在830K,2L密闭容器中发生反应:YZ(g)+X2Z(g)?YZ2(g)+X2(g),此温度下该反应平衡常数K=1.若YZ和X2Z起始的物质的量分别为4.0mol、6.0mol,5min后反应达到平衡,用X2表示的反应速率为 ,平衡时YZ的转化率为 .
查看习题详情和答案>>
(1)Q的离子结构示意图为
(2)工业电解QW饱和溶液时,阳极电极反应式为
(3)常温下,往甲溶液中通入一定量W的单质,充分反应后,得到溶液乙.
①将溶液乙滴在红色石蕊试纸上,可观察到现象是试纸先变蓝后褪色,其褪色原因是:
②溶液乙中某种溶质与Fe(OH)3在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
(4)在830K,2L密闭容器中发生反应:YZ(g)+X2Z(g)?YZ2(g)+X2(g),此温度下该反应平衡常数K=1.若YZ和X2Z起始的物质的量分别为4.0mol、6.0mol,5min后反应达到平衡,用X2表示的反应速率为