题目内容
(1)Q的离子结构示意图为
(2)工业电解QW饱和溶液时,阳极电极反应式为
(3)常温下,往甲溶液中通入一定量W的单质,充分反应后,得到溶液乙.
①将溶液乙滴在红色石蕊试纸上,可观察到现象是试纸先变蓝后褪色,其褪色原因是:
②溶液乙中某种溶质与Fe(OH)3在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
(4)在830K,2L密闭容器中发生反应:YZ(g)+X2Z(g)?YZ2(g)+X2(g),此温度下该反应平衡常数K=1.若YZ和X2Z起始的物质的量分别为4.0mol、6.0mol,5min后反应达到平衡,用X2表示的反应速率为
(1)Q为Na元素,Q的离子核外有10个电子,最外层电子数为8;
(2)电解饱和氯化钠溶液,氯离子在阳极被氧化生成氯气;
(3)常温下,往甲溶液中通入一定量W的单质,充分反应后,得到溶液乙,氯气与氢氧化钠反应生成氯化钠和次氯酸钠,次氯酸钠可生成HClO,HClO具有漂白性;溶液乙中某种溶质与Fe(OH)3在强碱性条件下反应可制取K2FeO4,乙应具有氧化性,应为NaClO,结合反应物和生成物书写反应的离子方程式;
(4)根据c=
| △c |
| △t |
(1)Q为Na元素,Q的离子核外有10个电子,最外层电子数为8,离子的结构示意图为
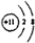 ,
,故答案为:
 ;
;(2)电解饱和氯化钠溶液,氯离子在阳极被氧化生成氯气,电极方程式为2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(3)常温下,往甲溶液中通入一定量W的单质,充分反应后,得到溶液乙,氯气与氢氧化钠反应生成氯化钠和次氯酸钠,
①次氯酸钠可与空气中二氧化碳反应生成HClO,或溶液中含有HClO,HClO具有漂白性,故答案为:因为溶液中含有HClO,HClO具有漂白性;
②溶液乙中某种溶质与Fe(OH)3在强碱性条件下反应可制取K2FeO4,乙应具有氧化性,应为NaClO,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-;
(4)已知反应:YZ(g)+X2Z(g)?YZ2(g)+X2(g),
起始(mol/L) 2 3
转化(mol/L) x x x x
平衡(mol/L)2-x 3-x x x
则
| x2 |
| (2-x)×(3-x) |
x=1.2mol/L,
用X2表示的反应速率为
| 1.2mol/L |
| 5min |
平衡时YZ的转化率为
| 1.2 |
| 2 |
故答案为:0.24mol/(L?min);60%.

X、Y、Z、Q、W五种元素的原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②X原子的价电子排布为nsnnpn;
③Y元素是空气中含量最多的元素;
④Z元素的电负性大于Y元素,Z原子核外的成对电子数与未成对电子数之比为3:1;
⑤Q元素的电离能数据见下表(单位:kJ/mol)。
|
I1 |
I2 |
I3 |
I4 |
I5[] |
...... |
|
578 |
1817 |
2745 |
11575 |
14380 |
...... |



 (1)
(1)

 W元素位于周期表的
区,Z2+ 的核外电子排布式是
。
W元素位于周期表的
区,Z2+ 的核外电子排布式是
。
(2)X、Y、Z三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)。
(3)Q元素在周期表中的位置为 (填周期数和族序数),它的稳定价态为 。
(4)常温下,Y单质的化学性质很稳定,原因是 。
(5)X的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
X、Y、Z、Q、W五种元素的原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②X原子的价电子排布为nsnnpn;
③Y元素是空气中含量最多的元素;
④Z元素的电负性大于Y元素,Z原子核外的成对电子数与未成对电子数之比为3:1;
⑤Q元素的电离能数据见下表(单位:kJ/mol)。
| I1 | I2 | I3 | I4 | I5[] | ...... |
| 578 | 1817 | 2745 | 11575 | 14380 | ...... |
(1)W元素位于周期表的 区,Z2+ 的核外电子排布式是 。
(2)X、Y、Z三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)。
(3)Q元素在周期表中的位置为 (填周期数和族序数),它的稳定价态为 。
(4)常温下,Y单质的化学性质很稳定,原因是 。
(5)X的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
 ①W的原子序数为29,其余的均为短周期主族元素;
①W的原子序数为29,其余的均为短周期主族元素;