题目内容
X、Y、Z和W为原子序数依次增大的短周期元素,X是空气中含量最高的元素,Y 和Z同主族,Z和W的气态氢化物具有相同的电子数,Y的单质只有氧化性.
(1)写出Z的气态氢化物的结构式
 .
.
(2)写出用惰性电极电解Cu(XY3)2溶液的离子反应方程式
(3)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究ZY2和W2的性质.
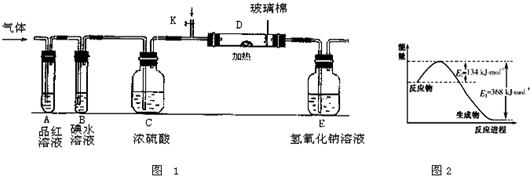
①分别通入ZY2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移的电子为5.0×10-5mol,则该反应的化学方程式为
(4)某同学将足量的ZY2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(5)图2是1molXO2和1molCO反应生成CO2和XO过程中能量变化示意图,请写出XO2和CO反应的热化学方程式
(6)盐酸肼(X2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与XH4Cl类似.
写出盐酸肼第一步水解反应的离子方程式
(1)写出Z的气态氢化物的结构式
H-S-H
H-S-H
,与W同周期惰性气体元素的原子结构示意图

(2)写出用惰性电极电解Cu(XY3)2溶液的离子反应方程式
2Cu2++2H2O
2Cu+4H++O2↑
| ||
2Cu2++2H2O
2Cu+4H++O2↑
.
| ||
(3)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究ZY2和W2的性质.

①分别通入ZY2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)
相同
相同
;②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移的电子为5.0×10-5mol,则该反应的化学方程式为
5Cl2+I2+6H2O=2HIO3+10HCl
5Cl2+I2+6H2O=2HIO3+10HCl
.(4)某同学将足量的ZY2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)
AC
AC
,可以看到白色沉淀生成,其原因为:当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀)
当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀)
(写出其中一种即可).A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(5)图2是1molXO2和1molCO反应生成CO2和XO过程中能量变化示意图,请写出XO2和CO反应的热化学方程式
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1
.(6)盐酸肼(X2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与XH4Cl类似.
写出盐酸肼第一步水解反应的离子方程式
N2H62++H2O?[N2H5?H2O]++H+
N2H62++H2O?[N2H5?H2O]++H+
.分析:X、Y、Z和W为原子序数依次增大的短周期元素,X是空气中含量最高的元素,故X为氮元素;Y 和Z同主族,Z和W的气态氢化物具有相同的电子数,Y的单质只有氧化性,故Y为氧元素,Z为硫元素.W为氯元素.
(1)硫化氢分子中氢原子与硫原子之间形成1对共用电子对;Ar原子核外有18个电子,有3个电子层,最外层电子数为8;
(2)阳离子Cu2+放电,阴离子为水电离的OH-放电生成氧气;
(3)①二氧化硫与品红化合物无色物质,氯气与水反应生成次氯酸,次氯酸具有强氧化性,将品红氧化为无色物质;
②令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得a=+5,所以碘单质被氧化为HIO3,据此书写方程式;
(4)当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀);
(5)由图2可知1molNO2和1molCO反应生成CO2和NO放出能量234kJ,据此书写热化学反应方程式;
(6)结构铵根离子的水解书写.
(1)硫化氢分子中氢原子与硫原子之间形成1对共用电子对;Ar原子核外有18个电子,有3个电子层,最外层电子数为8;
(2)阳离子Cu2+放电,阴离子为水电离的OH-放电生成氧气;
(3)①二氧化硫与品红化合物无色物质,氯气与水反应生成次氯酸,次氯酸具有强氧化性,将品红氧化为无色物质;
②令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得a=+5,所以碘单质被氧化为HIO3,据此书写方程式;
(4)当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀);
(5)由图2可知1molNO2和1molCO反应生成CO2和NO放出能量234kJ,据此书写热化学反应方程式;
(6)结构铵根离子的水解书写.
解答:解:X、Y、Z和W为原子序数依次增大的短周期元素,X是空气中含量最高的元素,故X为氮元素;Y 和Z同主族,Z和W的气态氢化物具有相同的电子数,Y的单质只有氧化性,故Y为氧元素,Z为硫元素.W为氯元素.
(1)Z为硫元素,Z的气态氢化物为硫化氢,分子中氢原子与硫原子之间形成1对共用电子对,结构式为H-S-H;W为氯元素
,与W同周期惰性气体元素是Ar,Ar原子核外有18个电子,有3个电子层,最外层电子数为8,Ar原子结构示意图为 ,故答案为:H-S-H;
,故答案为:H-S-H; ;
;
(2)用惰性电极电解Cu(NO3)2溶液,阳离子Cu2+放电,阴离子水电离的OH-放电生成氧气,离子反应方程式为2Cu2++2H2O
2Cu+4H++O2↑,故答案为:2Cu2++2H2O
2Cu+4H++O2↑;
(3)①二氧化硫与氯气都可以是品红溶液褪色,在装置A中观察到的现象是相同,故答案为:相同;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移的电子为5.0×10-5mol,令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得a=+5,所以碘单质被氧化为HIO3,则该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(4)当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀),
故答案为:AC;当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀);
(5)由图2可知1molNO2和1molCO反应生成CO2和NO放出能量234kJ,反应的热化学方程式为NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1,
故答案为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1;
(6)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
盐酸肼第一步水解反应的离子方程式为N2H62++H2O?[N2H5?H2O]++H+,
故答案为:N2H62++H2O?[N2H5?H2O]++H+.
(1)Z为硫元素,Z的气态氢化物为硫化氢,分子中氢原子与硫原子之间形成1对共用电子对,结构式为H-S-H;W为氯元素
,与W同周期惰性气体元素是Ar,Ar原子核外有18个电子,有3个电子层,最外层电子数为8,Ar原子结构示意图为
 ,故答案为:H-S-H;
,故答案为:H-S-H; ;
;(2)用惰性电极电解Cu(NO3)2溶液,阳离子Cu2+放电,阴离子水电离的OH-放电生成氧气,离子反应方程式为2Cu2++2H2O
| ||
| ||
(3)①二氧化硫与氯气都可以是品红溶液褪色,在装置A中观察到的现象是相同,故答案为:相同;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移的电子为5.0×10-5mol,令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得a=+5,所以碘单质被氧化为HIO3,则该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(4)当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀),
故答案为:AC;当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀);
(5)由图2可知1molNO2和1molCO反应生成CO2和NO放出能量234kJ,反应的热化学方程式为NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1,
故答案为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1;
(6)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
盐酸肼第一步水解反应的离子方程式为N2H62++H2O?[N2H5?H2O]++H+,
故答案为:N2H62++H2O?[N2H5?H2O]++H+.
点评:本题考查物质推断、结构性质位置关系、氧化还原反应、原电池、热化学方程式、水解等,难度中等,推断元素是关键,对基础知识掌握全面,注意(6)中为信息题,结合铵根离子的水解书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
