题目内容
(2012?枣庄二模)某实验小组用工业上废弃固体(主要成分为Cu2S和Fe2O3混合物)制取铜和FeCl3固体,设计的操作流程如下:
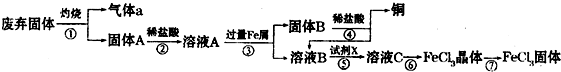
(1)除酒精灯和铁架台或三角架外,①中所需的容器为
(2)固体B加入稀盐酸后,④的操作是
(3)试剂x的化学式为
(4)在实验室中,用36.5%(密度为1.19g?mL-1)的盐酸,配制1L 3mol?L-1的盐酸,则需量取36.5%的盐酸
(5)简述溶液C中所含金属阳离子的检验方法
(6)第⑦步操作中,所需装置如图所示:
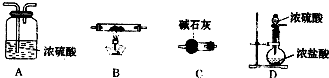
①按气流方向从左到右的顺序,各装置的连接顺序为
②C的作用是

(1)除酒精灯和铁架台或三角架外,①中所需的容器为
坩埚
坩埚
,①和⑥中都用到的仪器为玻璃棒
玻璃棒
.(2)固体B加入稀盐酸后,④的操作是
过滤、洗涤
过滤、洗涤
.(3)试剂x的化学式为
H2O2
H2O2
,X与溶液B反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)在实验室中,用36.5%(密度为1.19g?mL-1)的盐酸,配制1L 3mol?L-1的盐酸,则需量取36.5%的盐酸
252.1
252.1
mL.(5)简述溶液C中所含金属阳离子的检验方法
取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+
取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+
.(6)第⑦步操作中,所需装置如图所示:

①按气流方向从左到右的顺序,各装置的连接顺序为
DABC
DABC
.②C的作用是
吸收HCl和防止空气中的水蒸气进入
吸收HCl和防止空气中的水蒸气进入
.分析:(1)①、固体灼烧用到坩埚;①和⑥中都用到的玻璃棒;
(2)④的操作是过滤、洗涤;
(3)x为氧化剂,可以是双氧水,反应方程式:H2O2 2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)配制1L 3mol?L-1的盐酸需要氯化氢3mol,根据“36.5%(密度为1.19g?mL-1)的盐酸”求算盐酸的体积;
(5)三价铁离子的检验方法;
(6)①、先制取氯化氢气体,然后用浓硫酸干燥,再通入加热的氯化铁晶体,最后用碱石灰吸收氯化氢;
②、C的作用是吸收HCl和防止空气中的水蒸气进入.
(2)④的操作是过滤、洗涤;
(3)x为氧化剂,可以是双氧水,反应方程式:H2O2 2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)配制1L 3mol?L-1的盐酸需要氯化氢3mol,根据“36.5%(密度为1.19g?mL-1)的盐酸”求算盐酸的体积;
(5)三价铁离子的检验方法;
(6)①、先制取氯化氢气体,然后用浓硫酸干燥,再通入加热的氯化铁晶体,最后用碱石灰吸收氯化氢;
②、C的作用是吸收HCl和防止空气中的水蒸气进入.
解答:解:(1)①、灼烧固体应该放在坩埚中;①和⑥操作都用到玻璃棒,故答案为:坩埚; 玻璃棒;
(2)固体B加入稀盐酸后,再过滤、洗涤,得到A溶液,故答案为:过滤、洗涤;
(3)试剂X具有氧化性,将亚铁离子氧化成三价铁离子,可以选用双氧水,反应方程式为:2Fe2++H2O2 +2H+=2Fe3++2H2O;
故答案为:H2O2;2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)配制1L 3mol?L-1的盐酸,需要3mol的氯化氢,设需要36.5%(密度为1.19g?mL-1)的盐酸的体积为VmL,则有:3mol×36.5g/mol=VmL×1.19g?mL-1×36.5%,解得V=252.1mL;
故答案为:252.1;
(5)溶液C中所含金属阳离子是Fe3+,检验方法是:取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+;
故答案为:取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+;
(6)①、加热氯化铁晶体制取氯化铁固体,需要在氯化氢气体中进行,装置连接应该是先制取、干燥氯化氢,然后通入盛有氯化铁晶体的大试管,最后吸收氯化氢,连接顺序是:DABC,故答案为:DABC;
②、C是用来吸收氯化氢和防止水蒸气加入试管的,故答案为:吸收HCl和防止空气中的水蒸气进入.
(2)固体B加入稀盐酸后,再过滤、洗涤,得到A溶液,故答案为:过滤、洗涤;
(3)试剂X具有氧化性,将亚铁离子氧化成三价铁离子,可以选用双氧水,反应方程式为:2Fe2++H2O2 +2H+=2Fe3++2H2O;
故答案为:H2O2;2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)配制1L 3mol?L-1的盐酸,需要3mol的氯化氢,设需要36.5%(密度为1.19g?mL-1)的盐酸的体积为VmL,则有:3mol×36.5g/mol=VmL×1.19g?mL-1×36.5%,解得V=252.1mL;
故答案为:252.1;
(5)溶液C中所含金属阳离子是Fe3+,检验方法是:取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+;
故答案为:取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+;
(6)①、加热氯化铁晶体制取氯化铁固体,需要在氯化氢气体中进行,装置连接应该是先制取、干燥氯化氢,然后通入盛有氯化铁晶体的大试管,最后吸收氯化氢,连接顺序是:DABC,故答案为:DABC;
②、C是用来吸收氯化氢和防止水蒸气加入试管的,故答案为:吸收HCl和防止空气中的水蒸气进入.
点评:本题考查氯化铁固体的制取,注重了基础知识考查,注意分析题中信息,合理解答,本题难度中等.

练习册系列答案
相关题目