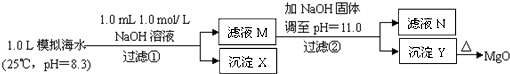
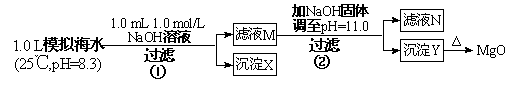
题目内容
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
| 模拟海水中的离子 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 浓度(mol/L) | 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.84×10-6;Ksp[Mg(OH)2]=5.61×10-12。
(1)沉淀物X的化学式为 ,生成X的离子方程式 。
(2)滤液N中存在的阳离子除Na+外还有 其物质的量浓度为 mol/L。
(3)若使2处pH为11,则需加入氢氧化钠固体质量为 g;(保留三位有效数字)
若使Y为纯净物,则2处加入氢氧化钠的质量最大值为 g. (保留三位有效数字)
(1)CaCO3;HCO3+Ca2++OH-= CaCO3↓+H2O
(2) Ca2+; 0.01mol
(3)4.04; 4.88

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2011?浙江)海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
|
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备Mg0的实验方案( )
已知:Kap[Mg(OH)4]=5.61×10-12 下列说法正确的是( ) |