摘要:不变 ②0.0075mol/
网址:http://m.1010jiajiao.com/timu_id_386578[举报]
碳元素的化合物如甲烷、碳酸钙在自然界储量丰富,分布广泛,有非常重要的用途.
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量的影响如下图:
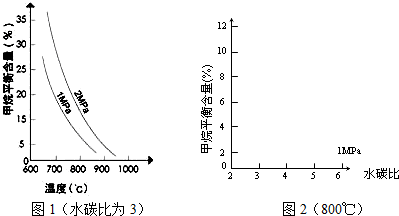
(1)温度对该反应的反应速率和平衡移动的影响是
(2)其他条件不变,请在图2中画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH4与一定量H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H2)为
(4)CaCO3是一种难溶物,其Ksp=2.8×10-9.现将 amol/L的CaCl2溶液与2.0×10-4mol/L Na2CO3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO3沉淀,则a的最小值为
查看习题详情和答案>>
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量的影响如下图:

(1)温度对该反应的反应速率和平衡移动的影响是
其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动
其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动
.(2)其他条件不变,请在图2中画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH4与一定量H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H2)为
0.4 mol/(L?min)
0.4 mol/(L?min)
;此条件下该反应的热化学方程式为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
.(4)CaCO3是一种难溶物,其Ksp=2.8×10-9.现将 amol/L的CaCl2溶液与2.0×10-4mol/L Na2CO3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO3沉淀,则a的最小值为
5.6×10-5
5.6×10-5
mol/L.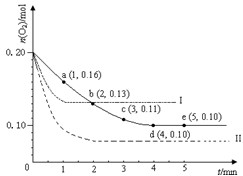 在一定温度下的2L密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化如图实线所示:
在一定温度下的2L密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化如图实线所示:(1)用SO2表示0~4min内该反应的平均速率为
(2)若温度不变,在容器中再加1mol O2,重新达到平衡,则SO2的平衡浓度
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是
在密闭容器内,使1mol N2 3mol H2混合发生下列反应:3H2+N2?2NH3 △H<0
(1)当反应达到平衡时,N2和H2的浓度比是
(2)保持体积不变,升高温度时,混合气体的平均相对分子是质量
(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将
(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将
(5)当达到平衡时,充入NH3气,并保持压强不变,平衡将
(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将
查看习题详情和答案>>
(1)当反应达到平衡时,N2和H2的浓度比是
1:3
1:3
.(2)保持体积不变,升高温度时,混合气体的平均相对分子是质量
减少
减少
,密度不变
不变
.(填增大、减少或不变,第3~6题填“正向”、“逆向”或“不”)(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将
不
不
移动.(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将
逆向
逆向
移动.(5)当达到平衡时,充入NH3气,并保持压强不变,平衡将
逆向
逆向
移动.(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将
正向
正向
移动.在一定条件下,可逆反应2NO2(g)?N2O4(g)△H<0达到平衡,当分别改变下列条件时,请填空:
(1)保持容器容积不变,通入一定量的NO2,则达到平衡时NO2的百分含量
(2)保持压强不变,通入一定量的NO2,则达到平衡时NOΡ的百分含量;保持压强不变,通入一定量N2O4,则达到平衡时NO2的百分含量
(3)保持容器容积不变,通入一定量的氖气,则达到平衡时NO2的转化率
查看习题详情和答案>>
(1)保持容器容积不变,通入一定量的NO2,则达到平衡时NO2的百分含量
减小
减小
(填“增大”、“减小”或“不变”,下同);保持容器容积不变,通入一定量N2O4,则达到平衡时NO2的百分含量减小
减小
.(2)保持压强不变,通入一定量的NO2,则达到平衡时NOΡ的百分含量;保持压强不变,通入一定量N2O4,则达到平衡时NO2的百分含量
不变
不变
.(3)保持容器容积不变,通入一定量的氖气,则达到平衡时NO2的转化率
不变
不变
;保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时NO2的转化率减小
减小
.对于2SO2(g)+O2(g)?2SO3(g)△H<0 反应来说:
(1)若将2mol SO2气体和1mol O2气体在2L容器中混合并在一定条件下发生反应,经2min建立平衡,此时测得SO3浓度为0.8mol?L-1,则从开始至2min用氧气表示的平均速率v(O2)=
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
A.升高温度B.降低温度C.增大压强 D.移出生成的SO3
(3)一定温度下,若将8mol SO2气体和4mol O2气体混合置于体积恒定的密闭容器中,能说明该反应已达到平衡状态的是
A.SO2的转化率和O2的转化率相等 B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变
(4)一定温度下,将8mol SO2和4mol O2气体混合置于体积不变的密闭容器中,经t1时间达到平衡,测得混合气体总物质的量为10mol.若此时向容器中充入一定量的氦气,SO3(g)的物质的量将
查看习题详情和答案>>
(1)若将2mol SO2气体和1mol O2气体在2L容器中混合并在一定条件下发生反应,经2min建立平衡,此时测得SO3浓度为0.8mol?L-1,则从开始至2min用氧气表示的平均速率v(O2)=
0.2mol?L-1?min-1
0.2mol?L-1?min-1
;该条件时反应的平衡常数K=160
160
.(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
B
B
(填字母).A.升高温度B.降低温度C.增大压强 D.移出生成的SO3
(3)一定温度下,若将8mol SO2气体和4mol O2气体混合置于体积恒定的密闭容器中,能说明该反应已达到平衡状态的是
BC
BC
.A.SO2的转化率和O2的转化率相等 B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变
(4)一定温度下,将8mol SO2和4mol O2气体混合置于体积不变的密闭容器中,经t1时间达到平衡,测得混合气体总物质的量为10mol.若此时向容器中充入一定量的氦气,SO3(g)的物质的量将
不变
不变
(填“增大”、“减小”或“不变”);若使SO2、O2、SO3三种气体均增加1mol,则平衡向右移动
向右移动
(填“向左移动”、“向右移动”或“不移动”).