题目内容
碳元素的化合物如甲烷、碳酸钙在自然界储量丰富,分布广泛,有非常重要的用途.
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量的影响如下图:
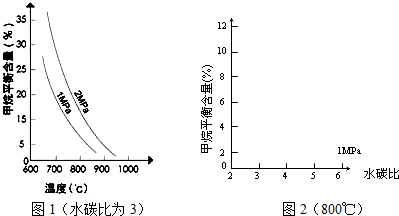
(1)温度对该反应的反应速率和平衡移动的影响是
(2)其他条件不变,请在图2中画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH4与一定量H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H2)为
(4)CaCO3是一种难溶物,其Ksp=2.8×10-9.现将 amol/L的CaCl2溶液与2.0×10-4mol/L Na2CO3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO3沉淀,则a的最小值为
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量的影响如下图:

(1)温度对该反应的反应速率和平衡移动的影响是
其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动
其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动
.(2)其他条件不变,请在图2中画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH4与一定量H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H2)为
0.4 mol/(L?min)
0.4 mol/(L?min)
;此条件下该反应的热化学方程式为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
.(4)CaCO3是一种难溶物,其Ksp=2.8×10-9.现将 amol/L的CaCl2溶液与2.0×10-4mol/L Na2CO3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO3沉淀,则a的最小值为
5.6×10-5
5.6×10-5
mol/L.分析:(1)根据图象中甲烷含量随温度变化分析;
(2)根据压强不变时,甲烷的百分含量随水碳比增大而减小来画出曲线;
(3)根据甲烷的量求出生成的氢气的量,然后求出氢气的反应速率;根据反应中热量变化为aKJ,求出1mol甲烷反应的热量,再写出热化学方程式;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍..
(2)根据压强不变时,甲烷的百分含量随水碳比增大而减小来画出曲线;
(3)根据甲烷的量求出生成的氢气的量,然后求出氢气的反应速率;根据反应中热量变化为aKJ,求出1mol甲烷反应的热量,再写出热化学方程式;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍..
解答:解:(1)由图象可知,其他条件不变,升高温度,反应速率加快,甲烷的百分含量减小,平衡向正反应方向移动,
故答案为:其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动;
(2)其他条件不变,压强为2MPa时,CH4平衡含量随水碳比的增大而减小,其关系曲线为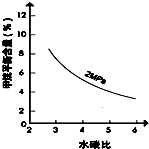 ,故答案为:
,故答案为: ;
;
(3)参加反应的CH4为:1mol×80%=0.8mol,所以生成的氢气为:n(H2)=3n(CH4)=2.4mol,v(H2)=
=
=0.4 mol/(L?min);
由图象可知,其他条件不变,升高温度,甲烷百分含量减少,平衡向正反应方向移动,正反应为吸热反应,
已知参加反应的物质的量之比等于热量比,则
=
,所以1mol甲烷反应吸收热量为:1.25a KJ,该反应的热化学方程式为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol;
(4)(2)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)=2.8×10-9可知,c(Ca2+)=
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,
故答案为:5.6×10-5mol/L.
故答案为:其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动;
(2)其他条件不变,压强为2MPa时,CH4平衡含量随水碳比的增大而减小,其关系曲线为
 ,故答案为:
,故答案为: ;
;(3)参加反应的CH4为:1mol×80%=0.8mol,所以生成的氢气为:n(H2)=3n(CH4)=2.4mol,v(H2)=
| ||
| t |
| ||
| 6min |
由图象可知,其他条件不变,升高温度,甲烷百分含量减少,平衡向正反应方向移动,正反应为吸热反应,
已知参加反应的物质的量之比等于热量比,则
| 0.8mol |
| aKJ |
| 1mol |
| △H |
故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol;
(4)(2)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 2.8×10-9 |
| 1×10-4 |
故答案为:5.6×10-5mol/L.
点评:本题考查化学平衡移动以及平衡移动图象问题,热化学方程式的书写,沉淀溶解平衡的应用,题目难度较大.

练习册系列答案
相关题目
现有部分短周期主族元素的有关信息,如下表:
|
元素编号 |
T |
X |
Y |
Z |
W |
|
元素的性质或原子结构情况 |
短周期主族元素中原子半径最大 |
最外层上的电子数比次外层少1个且单质是气体 |
核外共有13种运动状态不同的电子 |
若低温蒸发液态空气,因其沸点较低可先获得它的单质 |
核外有5种不同能量的电子且其中有两个未成对的电子 |
(1)Y的最外层电子排布式是__ __,它的单质与碳生成的化合物与水反应生成甲烷和白色沉淀。写出该反应的化学方程式__ 。
(2)元素T的单质与水反应的离子方程式是 ,
在短周期主族元素中,X元素与其相邻元素的原子半径从小到大的顺序是_
(写元素符号)。
(3)W形成的一种单质,其式量为256,易溶于CS2,该单质的化学式为___ __,它属于_ ___晶体(写晶体类型)。
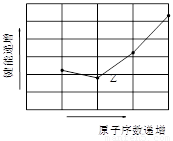
(4)如图为Z元素所在周期气态氢化物R-H键的键能大小,则该周期元素气态氢化物键能大小与键长的关系为___ __ (用文字简述)。

 b
b 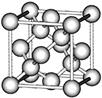 c
c 
 点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。