摘要:(3)4Fe3++2H2OO2+4H++4Fe3+0.8mol
网址:http://m.1010jiajiao.com/timu_id_386559[举报]
 (2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)已知O3与KI溶液反应的生成物中有两种单质,其离子反应方程式为
O3+2I-+H2O=O2+I2+2OH-
O3+2I-+H2O=O2+I2+2OH-
.(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.
已知:O3的起始浓度为0.0216mol/L.
pH t/min T/℃ |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
OH-
OH-
.②在30℃、pH=4.0条件下,O3的分解速率为
1.00×10-4
1.00×10-4
mol/(L?min).③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
b、a、c
b、a、c
.(填字母代号)a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得.
①图中阴极为
A
A
(填“A”或“B”),其电极反应式为2H++2e-═H2↑
2H++2e-═H2↑
.②若C处通入O2,则A极的电极反应式为
O2+4H++4e-═2H2O
O2+4H++4e-═2H2O
.根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示)

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:
(2)某同学取X的溶液,酸化后通入氧气再加入KI、淀粉溶液,变为蓝色,写出与上述变化过程相关的离子方程式:
(3)写出Cl2将Z氧化为K2EO4的化学方程式:
查看习题详情和答案>>

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:
Cu+H2SO4+H2O2=CuSO4+2H2O
Cu+H2SO4+H2O2=CuSO4+2H2O
.(2)某同学取X的溶液,酸化后通入氧气再加入KI、淀粉溶液,变为蓝色,写出与上述变化过程相关的离子方程式:
4Fe2++4H++O2=4Fe3++2H2O
4Fe2++4H++O2=4Fe3++2H2O
、2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
.(3)写出Cl2将Z氧化为K2EO4的化学方程式:
2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
.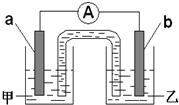 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:(1)将反应Zn+2H+═Zn2++H2↑拆写为两个“半反应式”:其中,氧化反应式为:
Zn=Zn2++2e-
Zn=Zn2++2e-
.(2)由题(1)反应,设计成原电池如图所示:若电极a为Zn,电极b可选择材料:
铜
铜
(只填一种);电解质溶液甲是ZnSO4
ZnSO4
;电极b处的电极反应式:2H++2e-=H2↑
2H++2e-=H2↑
.(3)由反应2H2+O2
| ||
2H2-4e-=4H+
2H2-4e-=4H+
,正极O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
.(4)以惰性材料为电极,电解100mL pH=6的硫酸铜溶液,当电解池内溶液的pH为1时,电极上析出的铜的质量为
0.32g
0.32g
(忽略电解前后溶液体积的变化).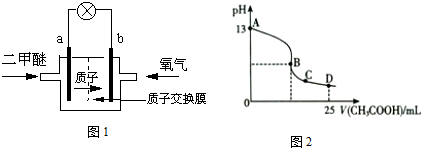 (1)二甲醚燃料电池的正极反应式为
(1)二甲醚燃料电池的正极反应式为O2+4H++4e-═2H2O
O2+4H++4e-═2H2O
.电池在放电过程中,负极周围溶液的pH减小
减小
.(填“增大”、“减小”或“不变”)(2)以上述电池为电源,通过导线电解池相连.两极为石墨,电解质溶液为1L 0.1mol/L KCl溶液,写出电解总反应的离子方程式为
2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
.
| ||
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到如图2.不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图2中的B点pH=7,则滴定终点在
AB
AB
区间(填“AB”、“BC”或“CD”).B点溶液中离子浓度大小为c(CH3COO-)=c(K+)>c(H+)=c(OH-)
c(CH3COO-)=c(K+)>c(H+)=c(OH-)
.②D点溶液中c(HAc)
<
<
c(Ac-)(填>、<或=).阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2═2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为
②正极反应式为
③工作一段时间后,溶液pH
(2)如把KOH改为稀H2SO4作电解质,则:
①负极反应式为
②正极反应式为
③工作一段时间后,溶液pH
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为
查看习题详情和答案>>
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为
2H2+4OH--4e-=4H2O
2H2+4OH--4e-=4H2O
②正极反应式为
O2+2H2O+4e-=4OH-.
O2+2H2O+4e-=4OH-.
③工作一段时间后,溶液pH
减小
减小
(填“增大”或“减小”或“不变”)(2)如把KOH改为稀H2SO4作电解质,则:
①负极反应式为
2H2-4e-═4H+
2H2-4e-═4H+
②正极反应式为
O2+4H++4e-═2H2O
O2+4H++4e-═2H2O
③工作一段时间后,溶液pH
增大
增大
(填“增大”或“减小”或“不变”).(3)如把H2改为甲烷,KOH作电解质,则正极反应式为
O2+2H2O+4e-=4OH-.
O2+2H2O+4e-=4OH-.
.