题目内容
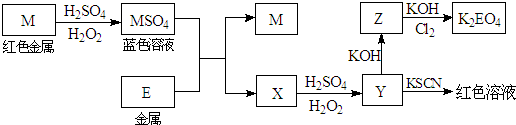
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示)

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:
(2)某同学取X的溶液,酸化后通入氧气再加入KI、淀粉溶液,变为蓝色,写出与上述变化过程相关的离子方程式:
(3)写出Cl2将Z氧化为K2EO4的化学方程式:

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:
Cu+H2SO4+H2O2=CuSO4+2H2O
Cu+H2SO4+H2O2=CuSO4+2H2O
.(2)某同学取X的溶液,酸化后通入氧气再加入KI、淀粉溶液,变为蓝色,写出与上述变化过程相关的离子方程式:
4Fe2++4H++O2=4Fe3++2H2O
4Fe2++4H++O2=4Fe3++2H2O
、2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
.(3)写出Cl2将Z氧化为K2EO4的化学方程式:
2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
.分析:框图推断题要注意寻找解题的突破口,在本题中,红色的金属是铜,能使硫氰酸钾显红色的是三价铁,氯气具有较强的氧化性,能将金属氧化到最高价态.
解答:解:根据图中的信息,可知M是金属铜,蓝色溶液即为硫酸铜,能使硫氰酸钾显红色的是三价铁离子,所以Y是三价铁盐,X中含有亚铁离子,所以金属E是铁,X是硫酸亚铁,Z是氢氧化铁沉淀,氯气具有较强的氧化性,能将金属铁氧化到最高价态+6价.
(1)金属铜在双氧水的氧化作用下和硫酸反应的方程式为:Cu+H2SO4+H2O2=CuSO4+2H2O,故答案为:Cu+H2SO4+H2O2=CuSO4+2H2O;
(2)亚铁离子具有较强的还原性,能被氧气氧化为+3价,碘离子有还原性,三价铁具有氧化性,二者之间发生氧化还原反应生成的碘单质能使淀粉变蓝,
故答案为:4Fe2++4H++O2=4Fe3++2H2O,2Fe3++2I-=2Fe2++I2;
(3)氯气具有强氧化性,能将三价铁氧化到+6价,反应原理为:2Fe(OH)3+3Cl2+10 KOH=2K2FeO4+6KCl+8H2O,故答案为:2Fe(OH)3+3Cl2+10 KOH=2K2FeO4+6KCl+8H2O.
(1)金属铜在双氧水的氧化作用下和硫酸反应的方程式为:Cu+H2SO4+H2O2=CuSO4+2H2O,故答案为:Cu+H2SO4+H2O2=CuSO4+2H2O;
(2)亚铁离子具有较强的还原性,能被氧气氧化为+3价,碘离子有还原性,三价铁具有氧化性,二者之间发生氧化还原反应生成的碘单质能使淀粉变蓝,
故答案为:4Fe2++4H++O2=4Fe3++2H2O,2Fe3++2I-=2Fe2++I2;
(3)氯气具有强氧化性,能将三价铁氧化到+6价,反应原理为:2Fe(OH)3+3Cl2+10 KOH=2K2FeO4+6KCl+8H2O,故答案为:2Fe(OH)3+3Cl2+10 KOH=2K2FeO4+6KCl+8H2O.
点评:本题考查学生物质的性质的有关知识,注意框图推断题要寻找合适的解题突破口是关键.

练习册系列答案
相关题目
 (2008?江苏)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
(2008?江苏)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有