网址:http://m.1010jiajiao.com/timu_id_382923[举报]
I.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液和双氧水.你认为要完成该实验所选择的试剂是
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测出上述样品中Fe2O3的质量分数.现有学生准备用如图各装置按一定顺序连接成一套完整的组合装置来进行实验以测定Fe2O3的质量分数.
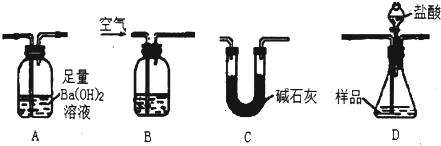
请根据题意回答下列问题:
(1)装置的连接顺序是
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还有一个重要作用是
(3)下列各项措施中,能提高测定准确度的是
a.在加入盐酸之前,应该排尽装置内的CO2气体
b.快速加入盐酸
c.在B中装入浓硫酸
d.在B中装入NaOH溶液
e.D之后增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验室准确称取26.0g固体样品装入D中,充分反应后,测得A中沉淀质量为19.7g,则样品中Fe2O3的质量分数为
(5)在进行实验方案评价时,有学生认为不必测定A中的沉淀质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将
欲测定金属镁的原子量.请利用如图给定的仪器组装一套实验装置(每件仪器只允许使用一次,假设各气体体积可看作是标准状况下测得).

填写下列各项(气体流向从左到右)
(1)各种仪器连接的先后顺序(用小写字母表示)应是________.
(2)连接好仪器后,要进行的操作有如下几步:
①待仪器B中的物质恢复至适当温度时,测得量筒C中水的体积为Va mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为m g,并将其投入试管B中的有孔隔板上;
③检查各装置的气密性;
④旋开仪器A上分液漏斗的活塞,使其中的水能顺利流下,当镁完全溶解时再关闭这个活塞,这时共在瓶A中放入水Vb mL.
上述操作的次序为(填序号)________.
(3)根据实验数据可算出金属镁的原子量,其数学表达式为________.
(4)若试管B的温度未冷却至室温,就测量量筒C中水的体积,这将会使所测原子量数据(填“偏高”、“偏低”、“无影响”)________;
(5)若未擦净镁条表面的氧化膜就进行实验,这将会使所测原子量数据(填“偏高”、“偏低”、“无影响”)________.
查看习题详情和答案>>钛(Ti)被称为继铁、铝之后的第三金属,也有人说21世纪是钛的世纪。钛在地壳中的含量并不少,但钛的冶炼技术还未获得突破,目前钛只用于尖端领域。
如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可大大提高资源利用率,减少环境污染。
请填写下列空白:
(1)用惰性电极电解2 L食盐水时,总反应的离子方程式_______________________________,当阴极上产生224 mL气体(标准状况)时,所得溶液的pH= (假设电解前后溶液体积不变,食盐水足量)。
(2)写出高温下钛铁矿经氯化得到四氯化钛的化学方程式 。(提示:FeTiO3中Ti为+4价)
(3)反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。
(4)二甲醚是一种重要的清洁燃料,可以通过甲醇分子间脱水制得:
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
T1 ℃时,在恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如下图所示。
①T1 ℃时,该反应的平衡常数为 ;
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)="0.4" mol/L、c(H2O)="0.6" mol/L、(CH3OCH3)="1.2" mol/L,此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
(5)在上述产业链中,合成192吨甲醇理论上需额外补充H2__________吨 (不考虑生产过程中物质的任何损失)。
钛(Ti)被称为继铁、铝之后的第三金属,也有人说21世纪是钛的世纪。钛在地壳中的含量并不少,但钛的冶炼技术还未获得突破,目前钛只用于尖端领域。
如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可大大提高资源利用率,减少环境污染。

请填写下列空白:
(1)用惰性电极电解2 L食盐水时,总反应的离子方程式_______________________________,当阴极上产生224 mL气体(标准状况)时,所得溶液的pH= (假设电解前后溶液体积不变,食盐水足量)。
(2)写出高温下钛铁矿经氯化得到四氯化钛的化学方程式 。(提示:FeTiO3中Ti为+4价)
(3)反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。
(4)二甲醚是一种重要的清洁燃料,可以通过甲醇分子间脱水制得:
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
T1 ℃时,在恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如下图所示。

①T1 ℃时,该反应的平衡常数为 ;
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)="0.4" mol/L、c(H2O)="0.6" mol/L、(CH3OCH3)="1.2" mol/L,此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
(5)在上述产业链中,合成192吨甲醇理论上需额外补充H2__________吨 (不考虑生产过程中物质的任何损失)。
查看习题详情和答案>>
如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可大大提高资源利用率,减少环境污染。
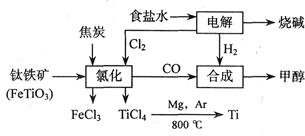
请填写下列空白:
(1)用惰性电极电解2 L食盐水时,总反应的离子方程式_______________________________,当阴极上产生224 mL气体(标准状况)时,所得溶液的pH= (假设电解前后溶液体积不变,食盐水足量)。
(2)写出高温下钛铁矿经氯化得到四氯化钛的化学方程式 。(提示:FeTiO3中Ti为+4价)
(3)反应2Mg+TiCl4
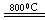 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。(4)二甲醚是一种重要的清洁燃料,可以通过甲醇分子间脱水制得:
2CH3OH(g)
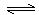 CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/molT1 ℃时,在恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如下图所示。
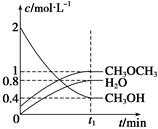
①T1 ℃时,该反应的平衡常数为 ;
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)="0.4" mol/L、c(H2O)="0.6" mol/L、(CH3OCH3)="1.2" mol/L,此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
(5)在上述产业链中,合成192吨甲醇理论上需额外补充H2__________吨 (不考虑生产过程中物质的任何损失)。