网址:http://m.1010jiajiao.com/timu_id_356208[举报]
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
CO2(g)+C(s)=2CO(g)△H2=+172.5kJ?mol-1
S(s)+O2(g)=SO2(g)△H3=-296.0kJ?mol-1
请写出CO除SO2的热化学方程式
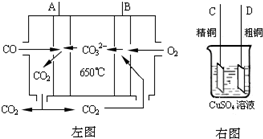
(3)如图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.回答下列问题:
①写出A极发生的电极反应式
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
③当消耗2.24L(标况下)CO时,粗铜电极理论上减少铜的质量
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55mol,CrO42-有
| 10 |
| 11 |
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol?L-1以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于
②还原法:CrO42-
| ||
| 氢离子 |
| 石灰水 |
(15分)
Ⅰ.(6分)光合作用是由二氧化碳与水合成葡萄糖,同时放出氧气。设想将该反应倒过来,可设计成一个原电池,产生电流,这样就将太阳能转变成了电能。
(1)写出该原电池的总反应式:______________________________________
(2)写出该电池在酸性介质中放电的电极反应式:
负极:_____________________________________________
正极:_____________________________________________
Ⅱ.(6分)类比思维是学习化学的重要方法,但结果是否正确必须经受检验。在进行类比思维的时候,不能机械类比,一定要注意一些物质的特殊性,以防止类比出错误的结论。凭已有的化学知识,下列类比结果正确的是:(填标序号) 。若错误,在其后写出正确的。
①在相同条件下,Na2CO3溶解度比NaHCO3大
类比:在相同条件下,CaCO3溶解度比Ca(HCO3)2大
正确的应该为(若类比正确,此处不写,下同。): 。
②向次氯酸钙溶液中通过量CO2:CO2 + ClO- + H2O = HCO3- + HClO
类比:向次氯酸钠溶液中通过量SO2:SO2 + ClO- +H2O = HSO3- + HClO
正确的应该为: 。
③根据化合价Fe3O4可表示为:FeO·Fe2O3 类比:Fe3I8也可表示为FeI2·2FeI3
正确的应该为: 。
④CaC2能水解:CaC2+2H2O =Ca(OH)2 + C2H2↑
类比:Al4C3也能水解:Al4C3 + 12H2O = 4Al(OH)3↓+ 3CH4↑
正确的应该为: 。
Ⅲ.(3分)常温下,某水溶液M中存在的离子有:Na+ 、A-、H+、OH-。若该溶液M由 pH=3的HA溶液
、A-、H+、OH-。若该溶液M由 pH=3的HA溶液 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液 mL混合反应而得,则下列说法中正确的是 (填字母)。
mL混合反应而得,则下列说法中正确的是 (填字母)。
| A.若溶液M呈中性,则溶液M中C(H+)+C(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,则溶液M的pH一定等于7 |
| C.若溶液M呈酸性,则V1一定大于V2 |
| D.若溶液M呈碱性,则V1一定小于V2 |
为减小和消除由于操作原因CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
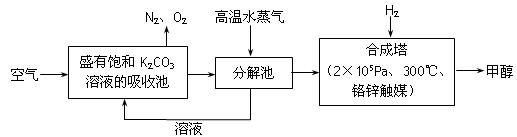
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是 。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e- == CO2 + 6H+
则正极发生的反应是 。
(3) 常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-) (填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
(4)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
查看习题详情和答案>>Ⅰ.(6分)光合作用是由二氧化碳与水合成葡萄糖,同时放出氧气。设想将该反应倒过来,可设计成一个原电池,产生电流,这样就将太阳能转变成了电能。
(1)写出该原电池的总反应式:______________________________________
(2)写出该电池在酸性介质中放电的电极反应式:
负极:_____________________________________________
正极:_____________________________________________
Ⅱ.(6分)类比思维是学习化学的重要方法,但结果是否正确必须经受检验。在进行类比思维的时候,不能机械类比,一定要注意一些物质的特殊性,以防止类比出错误的结论。凭已有的化学知识,下列类比结果正确的是:(填标序号) 。若错误,在其后写出正确的。
①在相同条件下,Na2CO3溶解度比NaHCO3大
类比:在相同条件下,CaCO3溶解度比Ca(HCO3)2大
正确的应该为(若类比正确,此处不写,下同。): 。
②向次氯酸钙溶液中通过量CO2:CO2 + ClO- + H2O = HCO3- + HClO
类比:向次氯酸钠溶液中通过量SO2:SO2 + ClO- +H2O = HSO3- + HClO
正确的应该为: 。
③根据化合价Fe3O4可表示为:FeO·Fe2O3 类比:Fe3I8也可表示为FeI2·2FeI3
正确的应该为: 。
④CaC2能水解:CaC2+2H2O =Ca(OH)2 + C2H2↑
类比:Al4C3也能水解:Al4C3 + 12H2O = 4Al(OH)3↓+ 3CH4↑
正确的应该为: 。
Ⅲ.(3分)常温下,某水溶液M中存在的离子有:Na+
 、A-、H+、OH-。若该溶液M由 pH=3的HA溶液
、A-、H+、OH-。若该溶液M由 pH=3的HA溶液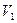 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液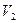 mL混合反应而得,则下列说法中正确的是 (填字母)。
mL混合反应而得,则下列说法中正确的是 (填字母)。| A.若溶液M呈中性,则溶液M中C(H+)+C(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,则溶液M的pH一定等于7 |
| C.若溶液M呈酸性,则V1一定大于V2 |
| D.若溶液M呈碱性,则V1一定小于V2 |
 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:(1)H2CO3、HCO3-、CO32-中不能大量共存于同一溶液中的是
(2)实验室可用“双指示剂法”测定碳酸钠、碳酸氢钠混合溶液中各种物质的含量,操作步骤如下:
①取固体样品配成溶液;
②取25mL样品溶液加指示剂A,用0.1010mol/LNaOH标准溶液滴定至终点;
③再加指示剂B,再用0.1010mol/LNaOH标准溶液滴定至终点…
指示剂B的变色范围在pH=
(3)当pH=7时,此时再滴入盐酸溶液所发生反应离子方程式是
(4)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=
c(
| ||
c(
|
II.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A
 H++HA- HA-
H++HA- HA- H++A2-
H++A2-已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.02mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(5)c(H+)最大的是