题目内容
Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料.
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)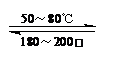 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
CO2(g)+C(s)=2CO(g)△H2=+172.5kJ?mol-1
S(s)+O2(g)=SO2(g)△H3=-296.0kJ?mol-1
请写出CO除SO2的热化学方程式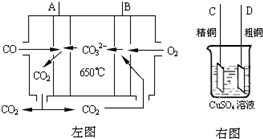
(3)如图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.回答下列问题:
①写出A极发生的电极反应式
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
③当消耗2.24L(标况下)CO时,粗铜电极理论上减少铜的质量
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55mol,CrO42-有
转化为Cr2O72-.又知:常温时该反应的平衡常数K=1014.上述酸化后所得溶液的pH=
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol?L-1以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于
②还原法:CrO42-
Cr3+
Cr(OH)3.用该方法处理10m3 CrO42-的物质的量浓度为1.0×10-3 mol?L-1的废水,至少需要绿矾(FeSO4?7H2O,相对分子质量为278)
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)
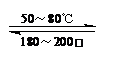 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H<
<
0 (选填“>”或“=”或“<”).(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
CO2(g)+C(s)=2CO(g)△H2=+172.5kJ?mol-1
S(s)+O2(g)=SO2(g)△H3=-296.0kJ?mol-1
请写出CO除SO2的热化学方程式
2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270kJ?mol-1
2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270kJ?mol-1
.
(3)如图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.回答下列问题:
①写出A极发生的电极反应式
CO-2e-+CO32-=2CO2
CO-2e-+CO32-=2CO2
.②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
D
D
极 (填:“C”或“D”)相连.③当消耗2.24L(标况下)CO时,粗铜电极理论上减少铜的质量
小于
小于
(填:“大于”、“等于”或“小于”)6.4克.Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55mol,CrO42-有
| 10 |
| 11 |
6
6
.(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol?L-1以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于
2.4×10-4
2.4×10-4
mol?L-1,然后再进行后续处理方能达到国家排放标准.②还原法:CrO42-
| ||
| 氢离子 |
| 石灰水 |
8.34
8.34
Kg(保留两位小数).分析:Ⅰ.(1)根据大多数的化合反应为放热反应,放热反应的△H<0;
(2)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(3)根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;根据A为负极,B为正极,
粗铜精炼时,粗铜作阳极,与电源的正极相连;根据电子得失守恒以及粗铜中除了铜失去电子还有其他金属失去电子;
Ⅱ.(1)先根据平衡常数计算出H+的物质的量浓度,求出PH;
(2)①根据沉淀的溶度积来计算;
②根据化合价升降总数相等建立关系式计算出绿矾(FeSO4?7H2O)的质量;
(2)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(3)根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;根据A为负极,B为正极,
粗铜精炼时,粗铜作阳极,与电源的正极相连;根据电子得失守恒以及粗铜中除了铜失去电子还有其他金属失去电子;
Ⅱ.(1)先根据平衡常数计算出H+的物质的量浓度,求出PH;
(2)①根据沉淀的溶度积来计算;
②根据化合价升降总数相等建立关系式计算出绿矾(FeSO4?7H2O)的质量;
解答:解:Ⅰ.(1)反应Ni(s)+4CO(g) 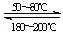 Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ?mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ?mol-1
(3)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D
③因粗铜中除了铜失去电子还有其他金属失去电子,根据电子得失守恒可知减少铜的质量小于6.4克,故答案:小于
Ⅱ.(1)根据元素守恒,起始CrO42的物质的量为0.55mol,反应后,溶液中CrO42的物质的量为为0.55mol×
=0.05mol,Cr2O72-的物质的量为0.55mol×
×
=0.25mol,设H+的物质的量浓度为amol/L,
2CrO42-+2H+?Cr2O72-+H2O
平衡(mol/L) 0.05 a 0.25
平衡常数K=
=
=1014,则a=1.0×10-6mol,PH=6,故答案为:6;
(2)①CrO42-+Ba2+?BaCrO4
5.0×10-7mol?L-1 C(Ba2+)
Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=5.0×10-7×C(Ba2+)=1.2×10-10,C(Ba2+)=2.4×10-4mol/L,
(2)②CrO42-
Cr3+,CrO42-中的Cr化合价由+6价降为+3价,FeSO4?7H2O中铁的化合价由+3价降为+2价,则有:CrO42-~~~~~~3FeSO4?7H2O
1 3
104L×1.0×10-3 mol?L-1 30mol
所以FeSO4?7H2O的质量为:30mol×278g/mol=8340g=8.34kg,故答案为:8.34;
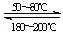 Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ?mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ?mol-1
(3)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D
③因粗铜中除了铜失去电子还有其他金属失去电子,根据电子得失守恒可知减少铜的质量小于6.4克,故答案:小于
Ⅱ.(1)根据元素守恒,起始CrO42的物质的量为0.55mol,反应后,溶液中CrO42的物质的量为为0.55mol×
| 1 |
| 11 |
| 10 |
| 11 |
| 1 |
| 2 |
2CrO42-+2H+?Cr2O72-+H2O
平衡(mol/L) 0.05 a 0.25
平衡常数K=
| c( Cr2O7 2-) |
| c2(H+ )c2(CrO4 2- ) |
| 0.25 |
| (0.05 ) 2×a 2 |
(2)①CrO42-+Ba2+?BaCrO4
5.0×10-7mol?L-1 C(Ba2+)
Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=5.0×10-7×C(Ba2+)=1.2×10-10,C(Ba2+)=2.4×10-4mol/L,
(2)②CrO42-
| ||
| 氢离子 |
1 3
104L×1.0×10-3 mol?L-1 30mol
所以FeSO4?7H2O的质量为:30mol×278g/mol=8340g=8.34kg,故答案为:8.34;
点评:本题是一道热化学和溶解平衡知识的题目,考查了学生热化学方程式的书写以及溶解平衡常数的有关知识,综合性强,难度较大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
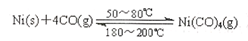

 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
,H2的平均生成速率为
。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
,H2的平均生成速率为
。
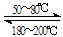 Ni(CO)4(g) 该反应的ΔH
▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH
▲ 0 (选填“>”或“=”或“<”)。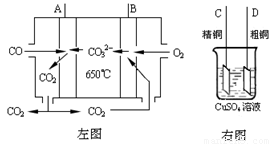
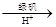 Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。