题目内容
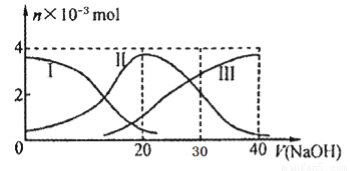
 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:(1)H2CO3、HCO3-、CO32-中不能大量共存于同一溶液中的是
H2CO3、CO32-
H2CO3、CO32-
.(2)实验室可用“双指示剂法”测定碳酸钠、碳酸氢钠混合溶液中各种物质的含量,操作步骤如下:
①取固体样品配成溶液;
②取25mL样品溶液加指示剂A,用0.1010mol/LNaOH标准溶液滴定至终点;
③再加指示剂B,再用0.1010mol/LNaOH标准溶液滴定至终点…
指示剂B的变色范围在pH=
4.5
4.5
左右最理想.(3)当pH=7时,此时再滴入盐酸溶液所发生反应离子方程式是
HCO3-+H+=H2CO3
HCO3-+H+=H2CO3
.(4)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=
c(
| ||
c(
|
10
10
.II.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A
 H++HA- HA-
H++HA- HA- H++A2-
H++A2-已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.02mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(5)c(H+)最大的是
A
A
,c(H2A)最大的是C
C
,c(A2-)最大的是D
D
.分析:Ⅰ.(1)根据各含碳微粒存在的PH范围分析;
(2)加入盐酸,先用酚酞作指示,当达滴定终点时可计算碳酸钠的浓度,在用甲基橙做指示剂,当达到滴定终点时可知碳酸氢钠的浓度;
(3)pH=7时,溶液主要存在的离子是HCO3-;
(4)根据平衡常数计算;
Ⅱ.从弱电解质的电离平衡和盐类的水解平衡移动的影响因素分析.
(2)加入盐酸,先用酚酞作指示,当达滴定终点时可计算碳酸钠的浓度,在用甲基橙做指示剂,当达到滴定终点时可知碳酸氢钠的浓度;
(3)pH=7时,溶液主要存在的离子是HCO3-;
(4)根据平衡常数计算;
Ⅱ.从弱电解质的电离平衡和盐类的水解平衡移动的影响因素分析.
解答:解:I.(1)由图象可以看出,H2CO3存在于PH<8的溶液中,CO32-存在于PH>8的溶液中,二者不能大量共存于同一溶液中,
故答案为:H2CO3、CO32-;
(2)试剂B为甲基橙,变色范围为3.1~4.4,当溶液颜色由黄色变为橙色时,pH约为4.5左右,故答案为:4.5;
(3)pH=7时,溶液主要存在的离子是HCO3-,滴入盐酸溶液所发生反应离子方程式是HCO3-+H+=H2CO3,故答案为:HCO3-+H+=H2CO3;
(4)当溶液中c(HCO3-):c(CO32-)=2:1时,根据Kh=
=2×10-4,
则有:c(OH-)=
=1×10-4,
c(H+)=
=1×10-10,
PH=-lg(10-10)=10,故答案为:10;
II.(5)C中的HCl与NaHA发生反应HCl+NaHA=H2A+NaCl后,得到0.01mol/LH2A和0.01mol/LNaHA的混合溶液,
D中0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合以后,发生反应NaOH+NaHA=Na2A+H2O,得到的是0.01mol/LNa2A溶液,以第一步水解为主,则c(A2-)最大,
根据相同浓度时的电离能力K1>>K2可知,C溶液中的HA-基本不电离,对溶液中c(H+)的增大贡献极小,
而由于浓度大,对H2A的电离平衡起抑制作用,致使C中c(H+)不如溶液A大,但c(H2A)大于A,
故答案为:A; C;D.
故答案为:H2CO3、CO32-;
(2)试剂B为甲基橙,变色范围为3.1~4.4,当溶液颜色由黄色变为橙色时,pH约为4.5左右,故答案为:4.5;
(3)pH=7时,溶液主要存在的离子是HCO3-,滴入盐酸溶液所发生反应离子方程式是HCO3-+H+=H2CO3,故答案为:HCO3-+H+=H2CO3;
(4)当溶液中c(HCO3-):c(CO32-)=2:1时,根据Kh=
c(
| ||
c(
|
则有:c(OH-)=
2×10-4×c(C
| ||
c(HC
|
c(H+)=
| 1×10-14 |
| 1×10-4 |
PH=-lg(10-10)=10,故答案为:10;
II.(5)C中的HCl与NaHA发生反应HCl+NaHA=H2A+NaCl后,得到0.01mol/LH2A和0.01mol/LNaHA的混合溶液,
D中0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合以后,发生反应NaOH+NaHA=Na2A+H2O,得到的是0.01mol/LNa2A溶液,以第一步水解为主,则c(A2-)最大,
根据相同浓度时的电离能力K1>>K2可知,C溶液中的HA-基本不电离,对溶液中c(H+)的增大贡献极小,
而由于浓度大,对H2A的电离平衡起抑制作用,致使C中c(H+)不如溶液A大,但c(H2A)大于A,
故答案为:A; C;D.
点评:本题考查较为综合,难度较大,注意双指示剂法的测定原理,为本题的易错点.

练习册系列答案
相关题目
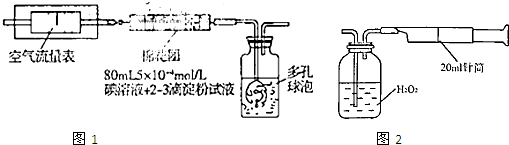

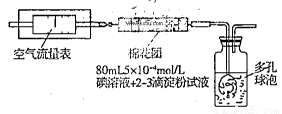
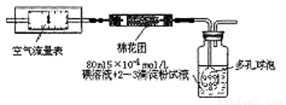
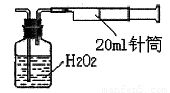
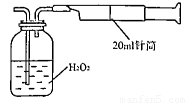 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。