网址:http://m.1010jiajiao.com/timu_id_317236[举报]
A卷
1.C 2.B 3.C 4.B 5.B 6.C 7.B 8.A 9.B 10.A 11.A 12.C 13.C 14.B 15.B
16. ①Fe3++3H2O Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
④Fe3++3NH3?H2O=Fe(OH)3+3NH4+ ⑤2Fe3++H2S=2Fe2++S↓+2H+(每个2分)
17. CH3OCH3+16OH--12e-=2CO32 -+11H2O;3O2+6H2O+12e-===12OH-;CH3OCH3+4OH-+3O2=2CO32 -+5H2O(每个2分)
18. (1)① Mg2+、SO42−、H+ ②Ba2+、NO3−、OH−;(全对给2分,答不全但答到H+ 或OH−得1分)
19. (1)0.2 mol(1分)(2)SO2、NO2(1分) (3)AC(全对给2分,答不全得1分)
20. (1)H2(1分)(2)①Fe+2H+=Fe2++H2↑②AlO2-+4H+=Al3++2H2O
③4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或:Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+、 4Fe(OH)2+O2+2H2O=4Fe(OH)3(每个2分)
(3) Al3+和Na+(全对给2分,答不全得1分) (4) H2SO4、HNO3(全对给2分,不全得1分)
21. (1)ECDBAGF(2分);酚酞(1分);无色变为浅红色(或粉红色)且半分钟不褪去(2分);
(2)偏大(1分)(3)100.00mL容量瓶(1分)(4)偏小 偏小 偏大(每个1分)
(5)4.20mol/L(2分)
22. (1) 7g;8g;(2) 3.5mol/L
B卷
B卷:23.C 24.D 25.C 26.B 27.B 28.C 29.D 30.C
31.(1)3.6 mol (2)≥0(说明:答“任意值”可得分)(3)3.6 mol< n(SO3)≤4 mol(每个2分)
32. (1)NH4C1、① ;(2)NH4Cl和NH3?H2O(答NH4Cl和NH3也给分);NH4Cl和HCl;
(3)小于 大于;(每个1分)
33. (1)将Fe3+ 还原为Fe2+;析出(或分离、或得到)FeSO4?7H2O;(每个2分)
(2) FeSO4?7H2O 石灰(或碳酸钙、废碱);(每个1分)
 (3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
(3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
34. (1)0.6 mol/L (2分);(2)97.5mL(2分);(3)35mL(3分)
| |||||||||||||||
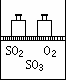
(1)在该平衡状态时n(SO3)=________;
(2)若起始时加入1.2 mol SO2、0.6 mol O2和x mol SO3,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的取值为________________;
(3)若反应开始时的v(逆)>v(正),达到上述平衡状态时,气体的总物质的量仍为4.2 mol。则起始时n(SO3)的取值范围是________________。
查看习题详情和答案>>
(1)在达到平衡状态向A的容器中通入少量O2,体系中SO2的体积分数____________(填“增大” “减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:____________或____________。
(2)若起始时a=1.2 mol,b=0.6 mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为____________。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是____________。
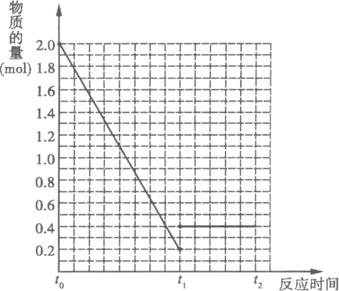
查看习题详情和答案>>(1)反应进行到t1时,SO2的体积分数___________;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将___________(填“增大”“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量___________2.1 mol(填“<”“>”或“=”),并简单说明原因____________________________________________;
(4)若其他条件不变,在t1时再加入0.2 molSO2、0.1 mol O2和1.8 mol SO3,在图中作出从t0![]() t1
t1![]() t2点这段时间内SO2的物质的量变化曲线。
t2点这段时间内SO2的物质的量变化曲线。

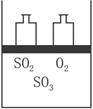
(1)甲容器达到平衡时SO2的转化率是____________,其所需时间____________50 s(填“大于”“小于”或“等于”)。
(2)达到平衡状态后,要使甲、乙两容器中SO2物质的量相等,可采取的措施是____________(填字母)。
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
查看习题详情和答案>>