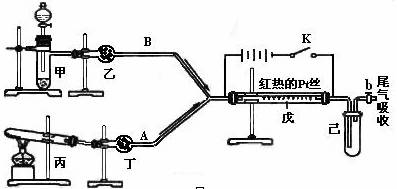
题目内容
如下图,将4 mol SO2和2 mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g) 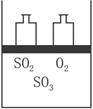
(1)在该平衡状态时n(SO3)=________;
(2)若起始时加入1.2 mol SO2、0.6 mol O2和x mol SO3,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的取值为________________;
(3)若反应开始时的v(逆)>v(正),达到上述平衡状态时,气体的总物质的量仍为4.2 mol。则起始时n(SO3)的取值范围是________________。
解析:(1)中达到平衡时n(SO3)=3.6 mol。?4 mol SO2和2 mol O2建立的平衡与从逆反应开始SO3=4 mol所建平衡等效平衡,故有此答案。
答案:(1)3.6 mol
2SO2+O2![]() 2SO3 Δn
2SO3 Δn
2 1
n(SO3) 6-4.2
n(SO3)=3.6 mol
(2)x≥0
恒温恒压下x≥0均符合等效平衡的条件。
(3)3.6 mol<n(SO3)<4 mol

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1 NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
| 实验步骤 | 实验结论 |
(1)A的质谱图如下: | (1)证明A的相对分子质量为:__________。 |
| (2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 | (2)证明A的分子式为: ________________。 |
| (3)另取两份9.0 g A分置于不同的试管中。 往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: | (4)A的结构简式为: _________________________。 |
有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1 NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
|
实验步骤 |
实验结论 |
|
(1)A的质谱图如下:
|
(1)证明A的相对分子质量为:__________。 |
|
(2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 |
(2)证明A的分子式为: ________________。 |
|
(3)另取两份9.0 g A分置于不同的试管中。 往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 |
(3)证明A的分子中含有一个羧基和一个羟基。 |
|
(4)A的核磁共振氢谱如下图:
|
(4)A的结构简式为: _________________________。 |