摘要:分小组讨论后各小组代表发言.[评价]同学们的发言很好.谈出了自己的体会和看法.上述两道信息题所展示的同分异构现象是同学们中学阶段还没有学习的“顺反异构 现象.通过上述分析可以看出同学们自学能力和信息检索能力在逐步提高.希望大家继续努力.下面我们再提供给同学们另一组信息题.[投影]
网址:http://m.1010jiajiao.com/timu_id_287698[举报]
某兴趣小组的同学在探究金属活动性顺序时,决定把铝片放入硫酸铜的水溶液中进行实验,以验证铝和铜的活动性顺序.小组的同学进行了分工,甲同学取一定量的无水硫酸铜粉末加到一定量的蒸馏水中溶解,发现溶液变浑浊,加水稀释仍然浑浊.
(1)你认为是什么原因造成的
(2)请你给出配制此溶液的建议
(3)经过小组讨论后,终于配制成澄清溶液.甲同学截取一段铝片放入盛有该硫酸铜溶液的试管中,观察,一开始无明显现象,一段时间后铝片表面先变
(4)乙同学认为将铝片放入前应
[提出问题]该气体是什么呢?
[猜想]①甲同学认为可能是氢气 ②乙同学认为可能是二氧化硫.
[查资料]铜盐溶液中,溶液的pH决定溶液中Cu2+浓度大小,通过查资料得到如下数据(Cu2+浓度小于1.0×10-5molL-1时忽略不计):
[方案设计]同学们设计方案逐一加以验证:
①
②
[讨论交流]你觉得还可以通过什么操作验证Al和Cu的活动性
查看习题详情和答案>>
(1)你认为是什么原因造成的
硫酸铜水解生成氢氧化铜沉淀
硫酸铜水解生成氢氧化铜沉淀
,写出反应的化学方程式CuSO4+2H2O=Cu(OH)2↓+H2SO4
CuSO4+2H2O=Cu(OH)2↓+H2SO4
.(2)请你给出配制此溶液的建议
取硫酸铜粉末加入少量硫酸再加适量蒸馏水稀释
取硫酸铜粉末加入少量硫酸再加适量蒸馏水稀释
.(3)经过小组讨论后,终于配制成澄清溶液.甲同学截取一段铝片放入盛有该硫酸铜溶液的试管中,观察,一开始无明显现象,一段时间后铝片表面先变
暗
暗
,随后溶液颜色变浅并在铝片表面沉积一层疏松的红色物质.(4)乙同学认为将铝片放入前应
先用砂纸打磨光亮
先用砂纸打磨光亮
,并重做此实验,除发现跟甲同学一样的现象外,还看到有气泡产生,于是激发了他们的探究欲望.[提出问题]该气体是什么呢?
[猜想]①甲同学认为可能是氢气 ②乙同学认为可能是二氧化硫.
[查资料]铜盐溶液中,溶液的pH决定溶液中Cu2+浓度大小,通过查资料得到如下数据(Cu2+浓度小于1.0×10-5molL-1时忽略不计):
| Cu2+/molL-1 | 0.1 | 0.01 | 0.001 | 0.0001 | 0.00001 |
| 溶液pH | 4.7 | 5.2 | 5.7 | 6.2 | 6.7 |
①
将产生的气体收集到小试管中,做爆鸣气实验
将产生的气体收集到小试管中,做爆鸣气实验
;②
将产生的气体通入品红溶液汇总,观察是否褪色
将产生的气体通入品红溶液汇总,观察是否褪色
.[讨论交流]你觉得还可以通过什么操作验证Al和Cu的活动性
分别取铜片和铝片,加入稀盐酸中观察
分别取铜片和铝片,加入稀盐酸中观察
.某兴趣小组的同学在探究金属活动性顺序时,决定把铝片放入硫酸铜的水溶液中进行实验,以验证铝和铜的活动性顺序.小组的同学进行了分工,甲同学取一定量的无水硫酸铜粉末加到一定量的蒸馏水中溶解,发现溶液变浑浊,加水稀释仍然浑浊.
(1)你认为是什么原因造成的______,写出反应的化学方程式______.
(2)请你给出配制此溶液的建议______.
(3)经过小组讨论后,终于配制成澄清溶液.甲同学截取一段铝片放入盛有该硫酸铜溶液的试管中,观察,一开始无明显现象,一段时间后铝片表面先变______,随后溶液颜色变浅并在铝片表面沉积一层疏松的红色物质.
(4)乙同学认为将铝片放入前应______,并重做此实验,除发现跟甲同学一样的现象外,还看到有气泡产生,于是激发了他们的探究欲望.
[提出问题]该气体是什么呢?
[猜想]①甲同学认为可能是氢气 ②乙同学认为可能是二氧化硫.
[查资料]铜盐溶液中,溶液的pH决定溶液中Cu2+浓度大小,通过查资料得到如下数据(Cu2+浓度小于1.0×10-5molL-1时忽略不计):
| Cu2+/molL-1 | 0.1 | 0.01 | 0.001 | 0.0001 | 0.00001 |
| 溶液pH | 4.7 | 5.2 | 5.7 | 6.2 | 6.7 |
①______;
②______.
[讨论交流]你觉得还可以通过什么操作验证Al和Cu的活动性______. 查看习题详情和答案>>
甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素.其设计的实验方案如下,请你帮他填写完整,并做出评价.
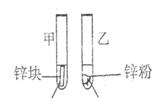
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
【评价】甲同学设计的实验方案的合理性是
A.非常合理B.部分合理C.完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是
(2)探究影响化学反应速率的因素
甲同学所得实验依据和结论有明显问题,问题是
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性.画出实验装置图,标出正负极、电子流动方向,写出电极反应式.
装置图

电极反应式
查看习题详情和答案>>
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
| 实验步骤 | 实验现象 | 实验结论及离子方程式 |
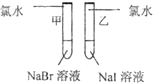 |
甲 溶液由无色变为橙色 溶液由无色变为橙色 乙 溶液由无色变为黄色 溶液由无色变为黄色 |
离子方程式 甲: 2Br-+Cl2═Br2+2Cl- 2Br-+Cl2═Br2+2Cl- 乙: 2I-+Cl2═2Cl-+I2 2I-+Cl2═2Cl-+I2 结论:卤素单质的氧化强到弱的顺序为Cl2>Br2>I2 |
B
B
(填序号)A.非常合理B.部分合理C.完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是
溴水
溴水
.(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
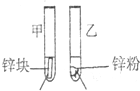 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) |
均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快. |
锌粉的表面积大,也能加快反应速率
锌粉的表面积大,也能加快反应速率
.(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性.画出实验装置图,标出正负极、电子流动方向,写出电极反应式.
装置图

电极反应式
负极:Fe-2e-═Fe2+
负极:Fe-2e-═Fe2+
正极:2H++2e-═H2↑
正极:2H++2e-═H2↑
.甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/ 盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
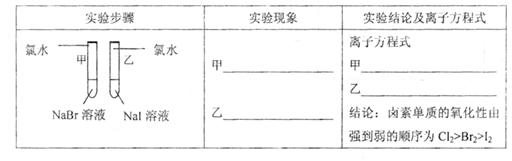
【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
|
3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是__________。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
装置图
|
|
电极反应式
____________________________
____________________________
查看习题详情和答案>>物质A有如图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化,F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明).请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)

回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性.则:
①反应Ⅲ的化学方程式为 .
②D与乙反应的离子方程式为
(2)第二种情况:甲由两种单质直接化合得到,乙为长周期金属;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成.则:
①工业上,反应 I的化学方程式为
②D和乙反应的离子方程式为
③请简述检验D溶液中阳离子的方法 .
④若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化.现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL.则该样品中A的质量分数= (列出计算式即可).
查看习题详情和答案>>

回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性.则:
①反应Ⅲ的化学方程式为
②D与乙反应的离子方程式为
(2)第二种情况:甲由两种单质直接化合得到,乙为长周期金属;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成.则:
①工业上,反应 I的化学方程式为
②D和乙反应的离子方程式为
③请简述检验D溶液中阳离子的方法
④若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化.现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL.则该样品中A的质量分数=