��Ŀ����
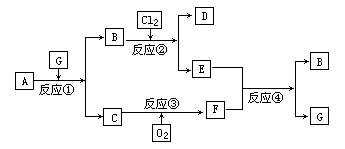
����A����ͼ��ʾת����ϵ��������Ϊ�������ʣ������£�����G ��Ũ��Һ�з����ۻ���F ����Һ��ֻ����һ�����ʣ��еķ�Ӧ������ˮ��Һ�н��У��еķ�Ӧ��������δȫ����������Ӧ����Ҳδע�������������������������ע����������¸���ĸ���������ʿ��ܲ�ͬ��
�ش��������⣺
��l����һ��������������������ֱ�պȡ A��G��Ũ��Һ��ʹ���ǽӽ�ʱ���д����������ɣ���Ϊ��ɫ��Ӧ�ʻ�ɫ�Ľ������ʣ� D �� F ����Һ���ʼ��ԣ���
�ٷ�Ӧ��Ļ�ѧ����ʽΪ ��
��D���ҷ�Ӧ�����ӷ���ʽΪ
��2���ڶ���������������ֵ���ֱ�ӻ��ϵõ�����Ϊ�����ڽ�����B Ϊ����ɫ���壻 CΪ��ɫ���壬���γ�����Ĵ�����Ⱦ��֮һ��D ��ˮ��Һ�����������ữ��AgNO3��Һ�а�ɫ�������ɣ���
�ٹ�ҵ�ϣ���Ӧ I�Ļ�ѧ����ʽΪ
��D���ҷ�Ӧ�����ӷ���ʽΪ
�����������D��Һ�������ӵķ��� ��
����A����Է�������Ϊ120����Ӧ���Ϊ��ȫת������ȡm�˺�A���������ʵ���Ʒ�����������̳�ַ�Ӧ�����ʲ����뷴Ӧ�����õ��ܶ�Ϊ��g/cm3��������������Ϊa% ��G��Һn mL�������Ʒ��A����������= ���г�����ʽ���ɣ���

�ش��������⣺
��l����һ��������������������ֱ�պȡ A��G��Ũ��Һ��ʹ���ǽӽ�ʱ���д����������ɣ���Ϊ��ɫ��Ӧ�ʻ�ɫ�Ľ������ʣ� D �� F ����Һ���ʼ��ԣ���
�ٷ�Ӧ��Ļ�ѧ����ʽΪ
��D���ҷ�Ӧ�����ӷ���ʽΪ
��2���ڶ���������������ֵ���ֱ�ӻ��ϵõ�����Ϊ�����ڽ�����B Ϊ����ɫ���壻 CΪ��ɫ���壬���γ�����Ĵ�����Ⱦ��֮һ��D ��ˮ��Һ�����������ữ��AgNO3��Һ�а�ɫ�������ɣ���
�ٹ�ҵ�ϣ���Ӧ I�Ļ�ѧ����ʽΪ
��D���ҷ�Ӧ�����ӷ���ʽΪ
�����������D��Һ�������ӵķ���
����A����Է�������Ϊ120����Ӧ���Ϊ��ȫת������ȡm�˺�A���������ʵ���Ʒ�����������̳�ַ�Ӧ�����ʲ����뷴Ӧ�����õ��ܶ�Ϊ��g/cm3��������������Ϊa% ��G��Һn mL�������Ʒ��A����������=
��������1���������������ֱ�պȡX��D��Ũ��Һ��ʹ���߿���ʱ���д����������ɣ�ӦΪNH3�ͻӷ�����ķ�Ӧ����ת����ϵ��֪AΪNH3����CΪNO��EΪNO2��GΪHNO3��BΪH2O����Ϊ��ɫ��Ӧ�ʻ�ɫ�Ľ������ʣ�ӦΪNa��D��F����Һ���ʼ��ԣ�����֪DΪNaOH����Ϊ�������ʣ������£�����Ũ�����з����ۻ�������NaOH��Һ��Ӧ����F������ΪAl��FΪNaAlO2��
��2��CΪ��ɫ���壬���γ�����Ĵ�����Ⱦ��֮һ����CΪSO2�����ת����ϵ����֪��EΪSO3��GΪH2SO4��A��������Ӧ����B���������BΪ����ɫ�Ĺ��壬A����Է�������Ϊ120������֪AΪFeS2��BΪFe2O3���������ֵ���ֱ�ӻ��ϵõ�������������Ӧ����D��D ��ˮ��Һ�����������ữ��AgNO3��Һ�а�ɫ�������ɣ�����Cl-������֪��ΪHCl��DΪFeCl3����Ϊ�����ڽ������ʣ������£�����Ũ�����з����ۻ���ӦΪFe�����Ȼ�����Һ��Ӧ����F��F����Һ��ֻ����һ�����ʣ���FΪFeCl2��
��2��CΪ��ɫ���壬���γ�����Ĵ�����Ⱦ��֮һ����CΪSO2�����ת����ϵ����֪��EΪSO3��GΪH2SO4��A��������Ӧ����B���������BΪ����ɫ�Ĺ��壬A����Է�������Ϊ120������֪AΪFeS2��BΪFe2O3���������ֵ���ֱ�ӻ��ϵõ�������������Ӧ����D��D ��ˮ��Һ�����������ữ��AgNO3��Һ�а�ɫ�������ɣ�����Cl-������֪��ΪHCl��DΪFeCl3����Ϊ�����ڽ������ʣ������£�����Ũ�����з����ۻ���ӦΪFe�����Ȼ�����Һ��Ӧ����F��F����Һ��ֻ����һ�����ʣ���FΪFeCl2��
����⣺��1���������������ֱ�պȡX��D��Ũ��Һ��ʹ���߿���ʱ���д����������ɣ�ӦΪNH3�ͻӷ�����ķ�Ӧ����ת����ϵ��֪AΪNH3����CΪNO��EΪNO2��GΪHNO3��BΪH2O����Ϊ��ɫ��Ӧ�ʻ�ɫ�Ľ������ʣ�ӦΪNa��D��F����Һ���ʼ��ԣ�����֪DΪNaOH����Ϊ�������ʣ������£�����Ũ�����з����ۻ�������NaOH��Һ��Ӧ����F������ΪAl��FΪNaAlO2����
�ٷ�Ӧ��Ļ�ѧ����ʽΪ��3NO2+H2O=2HNO3+NO���ʴ�Ϊ��3NO2+H2O=2HNO3+NO��
��D���ҷ�Ӧ�����ӷ���ʽΪ��2Al+2OH-+2H2O=AlO2-+3H2�����ʴ�Ϊ��2Al+2OH-+2H2O=AlO2-+3H2����
��2��CΪ��ɫ���壬���γ�����Ĵ�����Ⱦ��֮һ����CΪSO2�����ת����ϵ����֪��EΪSO3��GΪH2SO4��A��������Ӧ����B���������BΪ����ɫ�Ĺ��壬A����Է�������Ϊ120������֪AΪFeS2��BΪFe2O3���������ֵ���ֱ�ӻ��ϵõ�������������Ӧ����D��D ��ˮ��Һ�����������ữ��AgNO3��Һ�а�ɫ�������ɣ�����Cl-������֪��ΪHCl��DΪFeCl3����Ϊ�����ڽ������ʣ������£�����Ũ�����з����ۻ���ӦΪFe�����Ȼ�����Һ��Ӧ����F��F����Һ��ֻ����һ�����ʣ���FΪFeCl2����
�ٹ�ҵ�ϣ���ӦI�Ļ�ѧ����ʽΪ��4FeS2+11O2
2Fe2O3+8SO2���ʴ�Ϊ��4FeS2+11O2
2Fe2O3+8SO2��
��D���ҷ�Ӧ�����ӷ���ʽΪ��2Fe3++Fe=3Fe2+���ʴ�Ϊ��2Fe3++Fe=3Fe2+��
�ۼ���FeCl3��Һ�������ӵķ����ǣ�ȡ������Һ���Թ��У��μ�1��2�����軯����Һ����Һ�ʺ�ɫ��˵������Fe3+���ӣ�
�ʴ�Ϊ��ȡ������Һ���Թ��У��μ�1��2�����軯����Һ����Һ�ʺ�ɫ��˵������Fe3+���ӣ�
�������Ʒ��FeS2����������Ϊy����
FeS2����������������������2H2SO4
120 98��2
mg��y n���ѡ�a%g��
���У�120��98��2=mg��y��n���ѡ�a%g
���y=
��100%
�ʴ�Ϊ��
��100%��
�ٷ�Ӧ��Ļ�ѧ����ʽΪ��3NO2+H2O=2HNO3+NO���ʴ�Ϊ��3NO2+H2O=2HNO3+NO��
��D���ҷ�Ӧ�����ӷ���ʽΪ��2Al+2OH-+2H2O=AlO2-+3H2�����ʴ�Ϊ��2Al+2OH-+2H2O=AlO2-+3H2����
��2��CΪ��ɫ���壬���γ�����Ĵ�����Ⱦ��֮һ����CΪSO2�����ת����ϵ����֪��EΪSO3��GΪH2SO4��A��������Ӧ����B���������BΪ����ɫ�Ĺ��壬A����Է�������Ϊ120������֪AΪFeS2��BΪFe2O3���������ֵ���ֱ�ӻ��ϵõ�������������Ӧ����D��D ��ˮ��Һ�����������ữ��AgNO3��Һ�а�ɫ�������ɣ�����Cl-������֪��ΪHCl��DΪFeCl3����Ϊ�����ڽ������ʣ������£�����Ũ�����з����ۻ���ӦΪFe�����Ȼ�����Һ��Ӧ����F��F����Һ��ֻ����һ�����ʣ���FΪFeCl2����
�ٹ�ҵ�ϣ���ӦI�Ļ�ѧ����ʽΪ��4FeS2+11O2
| ||
| ||
��D���ҷ�Ӧ�����ӷ���ʽΪ��2Fe3++Fe=3Fe2+���ʴ�Ϊ��2Fe3++Fe=3Fe2+��
�ۼ���FeCl3��Һ�������ӵķ����ǣ�ȡ������Һ���Թ��У��μ�1��2�����軯����Һ����Һ�ʺ�ɫ��˵������Fe3+���ӣ�
�ʴ�Ϊ��ȡ������Һ���Թ��У��μ�1��2�����軯����Һ����Һ�ʺ�ɫ��˵������Fe3+���ӣ�
�������Ʒ��FeS2����������Ϊy����
FeS2����������������������2H2SO4
120 98��2
mg��y n���ѡ�a%g��
���У�120��98��2=mg��y��n���ѡ�a%g
���y=
| 120��n���ѡ�a% |
| 98��2��m |
�ʴ�Ϊ��
| 120��n���ѡ�a% |
| 98��2��m |
���������⿼��������ƶϣ���ɫ���������ʡ���Ӧ����Ϊ�ƶϵ�ͻ�ƿڣ�������ѧ������������Ԫ�ػ�����֪ʶ�Ŀ��飬��2����ע�����ù�ϵʽ���м��㣬�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
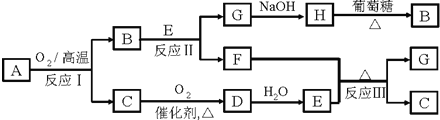
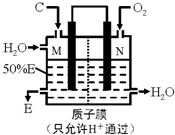
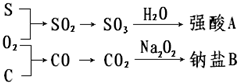 �������ʼ�����ͼ��ʾת����ϵ���ش��������⣺
�������ʼ�����ͼ��ʾת����ϵ���ش��������⣺