题目内容
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
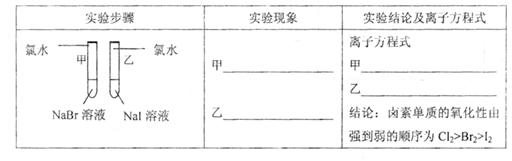
(1)探究同主族元素性质的递变规律
| 实验步骤 | 实验现象 | 实验结论及离子方程式 |
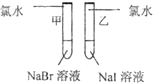 |
甲 溶液由无色变为橙色 溶液由无色变为橙色 乙 溶液由无色变为黄色 溶液由无色变为黄色 |
离子方程式 甲: 2Br-+Cl2═Br2+2Cl- 2Br-+Cl2═Br2+2Cl- 乙: 2I-+Cl2═2Cl-+I2 2I-+Cl2═2Cl-+I2 结论:卤素单质的氧化强到弱的顺序为Cl2>Br2>I2 |
A.非常合理B.部分合理C.完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是
(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
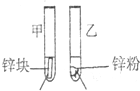 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) |
均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快. |
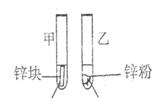
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性.画出实验装置图,标出正负极、电子流动方向,写出电极反应式.
装置图

电极反应式
(2)根据两支试管中锌的表面积大小也影响化学反应速率分析;
(3)比较铜和铁的金属活动性,利用原电池原理,铜丝和铁丝为原电池两极,以稀硫酸为电解质溶液,据此画出实验装置图,标出正负极、电子流动方向,并写出电极反应式.
乙试管中加入氯水,溶液中的碘离子被氯气氧化成碘单质,溶液由无色变为黄色,反应的离子方程式为:2I-+Cl2═2Cl-+I2,
由于乙试管使用的是氯水,无法证明溴单质的氧化性大于碘单质的氧化性,甲同学设计的实验方案部分合理,所以试管乙应该使用溴水,
故答案为:
| 实验现象 | 实验结论及离子方程式 |
| 甲:溶液由无色变为橙色 乙:溶液由无色变为黄色 |
甲 2Br-+Cl2═Br2+2Cl- 乙 2I-+Cl2═2Cl-+I2 |
(2)两支试管中盐酸的浓度和锌的表面积不同,盐酸的浓度和锌的表面积都影响化学反应速率,所以无法证明浓度对反应速率的影响,正确方法应该将锌都改用同样的规格,
故答案为:锌粉的表面积大,也能加快反应速率;
(3)用铁、铜作电极,稀硫酸作电解质溶液设计原电池,铁的金属性比铜强,所以铁作负极,铜作正极,电子从负极沿导线流向正极,画出的原电池装置图为:
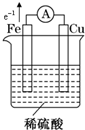
发生的电极反应为:负极:Fe-2e-═Fe2+;正极:2H++2e-═H2↑,
故答案为:
 ;负极:Fe-2e-═Fe2+;正极:2H++2e-═H2↑.
;负极:Fe-2e-═Fe2+;正极:2H++2e-═H2↑.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。

图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
|
温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。
甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/ 盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
|
3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是__________。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
装置图
|
|
电极反应式
____________________________
____________________________
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。

图 1 图 2
(1) 图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2) 小组同学提出了如下假设并设计实验探究:
Ⅰ. 甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ. 乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号),
A. 硝酸铜晶体 B. 硝酸铜溶液 C. 硫酸铜晶体 D. 硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论)
。