摘要:A.
网址:http://m.1010jiajiao.com/timu_id_287643[举报]
A.(1)请写出以乙烯为有机原料合成乙酸乙酯的各步反应方程式,并注明反应类型.
(2)下表是A、B二种有机物的有关信息;
根据表中信息回答下列问题:
①A的结构简式为
②写出在浓硫酸作用下A发生消去反应的化学方程式
③B具有的性质是
a.无色无味液体; b.有毒; c.不溶于水; d.密度比水大; e.与酸性KMnO4 溶液和溴水反应褪色; f.任何条件下不与氢气反应;
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HNO3(浓)
+HNO3(浓)

 +HNO3(浓)
+HNO3(浓)
 .
.
查看习题详情和答案>>
CH2=CH2+H2O
CH3CH2OH
| 催化剂 |
CH2=CH2+H2O
CH3CH2OH
:加成反应| 催化剂 |
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
| 浓硫酸 |
| △ |
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
:| 浓硫酸 |
| △ |
酯化反应
酯化反应
2CH3CHO+O2
2CH3COOH
| 催化剂 |
2CH3CHO+O2
2CH3COOH
:氧化反应| 催化剂 |
(2)下表是A、B二种有机物的有关信息;
| A | B |
| ①分子式为C3H8O; ②在Cu的作用下催化氧化的产物 不能发生银镜反应 |
①由C、H两种元素组成; ②球棍模型为:  |
①A的结构简式为
CH3CH(OH)CH3
CH3CH(OH)CH3
.②写出在浓硫酸作用下A发生消去反应的化学方程式
CH3CH(OH)CH3
CH2=CHCH3+H2O
| 浓H2SO4 |
| △ |
CH3CH(OH)CH3
CH2=CHCH3+H2O
.| 浓H2SO4 |
| △ |
③B具有的性质是
bc
bc
(填序号):a.无色无味液体; b.有毒; c.不溶于水; d.密度比水大; e.与酸性KMnO4 溶液和溴水反应褪色; f.任何条件下不与氢气反应;
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HNO3(浓)
+HNO3(浓)| 浓H2SO4 |
| △ |

 +HNO3(浓)
+HNO3(浓)| 浓H2SO4 |
| △ |

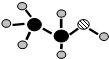 A.已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
A.已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的| 3 |
| 4 |
(1)D与E两元素相比较,非金属性较强的是
氯
氯
(填元素名称),请你自选试剂设计实验验证该结论(说明试剂、简单操作、实验现象)将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强
将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强
;(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为
HS-+OH-═S2-+H2O
HS-+OH-═S2-+H2O
;(3)由A、B、C三种元素组成的化合物的球棍结构如图:,试写出利用植物秸秆生产这种物质的化学方程式
(C6H10O5)n+nH2O
nC6H12O6
| 催化剂 |
| △ |
(C6H10O5)n+nH2O
nC6H12O6
、| 催化剂 |
| △ |
C6H12O6
2CH3CH2OH+2CO2↑
| 一定条件 |
C6H12O6
2CH3CH2OH+2CO2↑
.| 一定条件 |
A.不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀.
(1)基态碳(C)原子的轨道表示式为
 .
.
(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr的配位数为
 .
.
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是
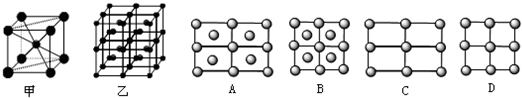
(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到A~B图中正确的是
(5)据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性.鉴于这三种元素都是常见元素,从而引起广泛关注.该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式


查看习题详情和答案>>
(1)基态碳(C)原子的轨道表示式为


(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr的配位数为
6
6
;已知CrO5中Cr为+6价,则CrO5的结构式为

(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是
分子晶体
分子晶体
,与Ni(CO)4中配体互为等电子的离子是CN-、C22-
CN-、C22-
.(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到A~B图中正确的是
A
A
.
(5)据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性.鉴于这三种元素都是常见元素,从而引起广泛关注.该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式
MgCNi3
MgCNi3
.晶体中每个镁原子周围距离最近的镍原子有12
12
个.

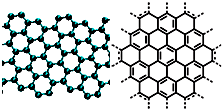 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:(1)下列有关石墨烯说法正确的是
BD
BD
.A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合.
①钴原子在基态时,核外电子排布式为:
[Ar]3d74s2
[Ar]3d74s2
.
②乙醇沸点比氯乙烷高,主要原因是
乙醇分子间可形成氢键,而氯乙烷分子间无氢键
乙醇分子间可形成氢键,而氯乙烷分子间无氢键
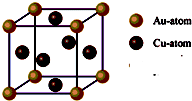
.③右图是金与铜形成的金属互化物合金,它的化学式可表示为:
Cu3Au或AuCu3
Cu3Au或AuCu3
.④含碳源中属于非极性分子的是
a、b、c
a、b、c
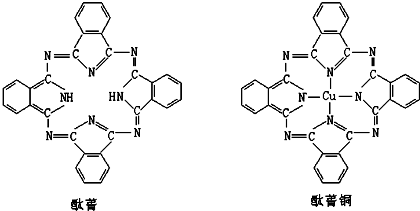
(a.甲烷 b.乙炔 c.苯 d.乙醇)⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:
sp3和sp2
sp3和sp2
;酞菁铜分子中心离子的配位数为:2
2
.
B.硫酸钾是重要的化工产品,生产方法很多,如曼海姆法、石膏两步转化法等.
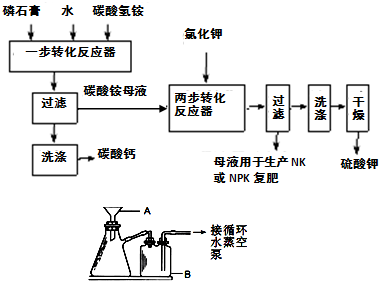
(1)本实验中,采用抽滤方法,图中A、B两仪器名称分别为:
布氏漏斗
布氏漏斗
、安全瓶
安全瓶
.(2)在一部转化反应器中发生的反应为:CaSO4?2H2O+2NH4HCO3=(NH4)2SO4+CaCO3+CO2↑+3H2O,该步反应温度必须低于35℃,其主要目的是
防止NH4HCO3分解
防止NH4HCO3分解
无此空
无此空
.(3)在两步转化反应器中发生反应的化学方程式为
(NH4)2SO4+2KCl=K2SO4+2NH4Cl
(NH4)2SO4+2KCl=K2SO4+2NH4Cl
无此空
无此空
.(4)两步转化反应器中用乙二醇代替水作溶剂,其目的是
降低K2SO4溶解度
降低K2SO4溶解度
有利于K2SO4析出,提高产率
有利于K2SO4析出,提高产率
.(5)磷石膏主要成分为二水硫酸钙(CaSO4?2H2O),还含有未分解的磷矿,未洗涤干净的磷酸、氟化钙、铁铝氧化物等,欲检验母液中含Fe3+,可用亚铁氰化钾溶液检验,该检验反应的离子方程式为:
Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓
Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓
.(6)该法优点除K2SO4产率高外,再列举一个优点
原料得到充分利用
原料得到充分利用
同时得到副产品化肥等
同时得到副产品化肥等
.A.《物质结构与性质》
锌是一种重要的金属,锌及其化合物有着广泛的应用.

(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子空间构型为
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键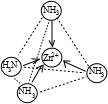
 .
.
(3)如图2表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
查看习题详情和答案>>
锌是一种重要的金属,锌及其化合物有着广泛的应用.

(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
1s22s22p63s23p63d10
1s22s22p63s23p63d10
;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式sp2、sp3
sp2、sp3
.(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子空间构型为
三角锥型
三角锥型
;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键


(3)如图2表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
ZnX
ZnX
;该化合物的晶体熔点比干冰高得多,原因是该化合物是原子晶体,而干冰是分子晶体
该化合物是原子晶体,而干冰是分子晶体
.