题目内容
A.《物质结构与性质》
锌是一种重要的金属,锌及其化合物有着广泛的应用.

(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子空间构型为
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键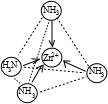
 .
.
(3)如图2表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
锌是一种重要的金属,锌及其化合物有着广泛的应用.

(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
1s22s22p63s23p63d10
1s22s22p63s23p63d10
;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式sp2、sp3
sp2、sp3
.(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子空间构型为
三角锥型
三角锥型
;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键


(3)如图2表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
ZnX
ZnX
;该化合物的晶体熔点比干冰高得多,原因是该化合物是原子晶体,而干冰是分子晶体
该化合物是原子晶体,而干冰是分子晶体
.分析:(1)Zn元素是30号元素,Zn原子形成离子先失去高能层中的电子,结合核外电子排布规律书写;
葡萄糖分子中-CHO中的C原子成2个单键、1个C=O,杂化轨道数为3,采取sp2杂化,其它C原子成4个单键,杂化轨道数为4,采取sp3杂化;
(2)NH3分子中N原子成3个N-H单键、含有1对孤对电子,杂化轨道数为4,采取sp3杂化,故NH3分子为三角锥型;
[Zn(NH3)4]2+中Zn2+有空轨道,N有孤对电子,[Zn(NH3)4]2+中Zn2+与N之间的化学键为配位键;
(3)由晶胞结构可知,晶胞中Zn原子处于晶胞内部,X原子处于顶点与面心,根据均摊法计算晶胞中X原子数目,据此书写化学式,晶胞中Zn和X通过共价键结合,故该晶体通过共价键形成的空间网状结构,属于原子晶体,熔点比分子晶体高.
葡萄糖分子中-CHO中的C原子成2个单键、1个C=O,杂化轨道数为3,采取sp2杂化,其它C原子成4个单键,杂化轨道数为4,采取sp3杂化;
(2)NH3分子中N原子成3个N-H单键、含有1对孤对电子,杂化轨道数为4,采取sp3杂化,故NH3分子为三角锥型;
[Zn(NH3)4]2+中Zn2+有空轨道,N有孤对电子,[Zn(NH3)4]2+中Zn2+与N之间的化学键为配位键;
(3)由晶胞结构可知,晶胞中Zn原子处于晶胞内部,X原子处于顶点与面心,根据均摊法计算晶胞中X原子数目,据此书写化学式,晶胞中Zn和X通过共价键结合,故该晶体通过共价键形成的空间网状结构,属于原子晶体,熔点比分子晶体高.
解答:解:(1)Zn元素是30号元素,Zn原子的核外电子排布式为1s22s22p63s23p63d104s2,故Zn2+的基态电子排布式为1s22s22p63s23p63d10,葡萄糖分子中-CHO中的C原子成2个单键、1个C=O,杂化轨道数为3,采取sp2杂化,其它C原子成4个单键,杂化轨道数为4,采取sp3杂化,故答案为:1s22s22p63s23p63d10,sp2、sp3;
(2)NH3分子中N原子成3个N-H单键、含有1对孤对电子,杂化轨道数为4,采取sp3杂化,故NH3分子为三角锥型,
[Zn(NH3)4]2+中Zn2+有空轨道,N有孤对电子,Zn2+与N之间的化学键为配位键 ,
,
故答案为:三角锥型, ;
;
(3)由晶胞结构可知,晶胞中Zn原子处于晶胞内部,晶胞中含有4个Zn原子,X原子处于顶点与面心,晶胞中X原子数目为8×
+6×
=4,故该化合物化学式为ZnX,晶胞中Zn和X通过共价键结合,故该晶体通过共价键形成的空间网状结构,属于原子晶体,干冰属于分子晶体,故该化合物的熔点比干冰高,
故答案为:ZnX,该化合物是原子晶体,而干冰是分子晶体.
(2)NH3分子中N原子成3个N-H单键、含有1对孤对电子,杂化轨道数为4,采取sp3杂化,故NH3分子为三角锥型,
[Zn(NH3)4]2+中Zn2+有空轨道,N有孤对电子,Zn2+与N之间的化学键为配位键
 ,
,故答案为:三角锥型,
 ;
;(3)由晶胞结构可知,晶胞中Zn原子处于晶胞内部,晶胞中含有4个Zn原子,X原子处于顶点与面心,晶胞中X原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:ZnX,该化合物是原子晶体,而干冰是分子晶体.
点评:本题主要考查核外电子排布规律、杂化轨道、化学键与晶胞结构等,难度不大,注意(1)中原子形成阳离子时先失去高能层中高能级的电子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号), )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。