摘要:C.. D..
网址:http://m.1010jiajiao.com/timu_id_262932[举报]
一、选择题(每小题3分,共51分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
A
C
C
C
C
C
B
D
A
B
B
D
B
C
A
C
D
二、填空题(21题(1)问每空1分,其余每空2分,共19分)
18.(10分)(1)① (2)①⑤ (3)4 (4)>7 (5)D
19.(8分)(1)

(2)
(3)
 20.(9分)(1)
20.(9分)(1)

 (各1分)
(各1分)
(2)
(3) (4)
(4)

21.(14分)(1)试管上部充满红棕色气体
(2)无; 与水反应生成了足量的
与水反应生成了足量的 ,中和了
,中和了
(3)
 只写第一个给全分
只写第一个给全分
(4) ;
; ;小
;小
22.(8分)(1)
(2)A、D
(3)3 

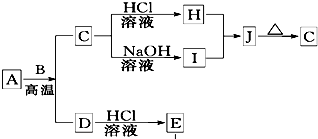 B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.(1)在E的溶液中加入氢氧化钠溶液,可以观察到的现象是
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
.(2)按要求写化学方程式或离子方程式:
①A与B在高温条件下生成C和D的化学方程式:
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
;
| ||
②在E的水溶液中通入氯气后的生成物和I溶液反应的离子方程式:
Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓
Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓
.(3)由D和A组成的混合物与稀HCl作用,固体恰好溶解,所得溶液中滴加KSCN溶液不显红色,且生成的E与H2的物质的量之比为4:1.则反应物中A、D、HCl的物质的量之比为
1:2:8
1:2:8
.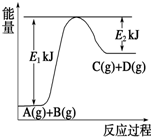 Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.(1)该反应是
吸热
吸热
反应(填“吸热”或“放热”),该反应的△H=E1-E2
E1-E2
kJ?mol-1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量一定低
一定低
(填“一定高”、“一定低”或“高低不一定”).(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1
减小
减小
,E2减小
减小
,△H不变
不变
(填“增大”、“减小”或“不变”).Ⅱ.已知下列热化学方程式
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ?mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ?mol-1 ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ?mol-1③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol
CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol
.Ⅰ.将70mL NO和O2的混合气体通入足量的水中.(1)若正好完全反应生成HNO3,则原混合气体中O2和NO各多少毫升?(2)若在相同条件下收集到7mL剩余气体,则原混合气体中O2和NO各多少毫升?
Ⅱ.已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.

(1)D的焰色反应为黄色,则D的化学式为:
(2)写出反应①的离子反应方程式:
写出反应③的离子反应方程式:
(3)写出反应②的化学方程式:
(4)1mol C通过反应④得到1mol G,C中G的质量分数为72%,则C的化学式为:
查看习题详情和答案>>
Ⅱ.已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.

(1)D的焰色反应为黄色,则D的化学式为:
NaOH
NaOH
;F的化学式为N2
N2
;(2)写出反应①的离子反应方程式:
2Na2O2+2H2O═4Na++4OH-+O2↑
2Na2O2+2H2O═4Na++4OH-+O2↑
;写出反应③的离子反应方程式:
3NO2+H2O═2H++2NO3-+NO
3NO2+H2O═2H++2NO3-+NO
.(3)写出反应②的化学方程式:
Ag+2HNO3═AgNO3+NO2↑+H2O
Ag+2HNO3═AgNO3+NO2↑+H2O
.(4)1mol C通过反应④得到1mol G,C中G的质量分数为72%,则C的化学式为:
AgN3
AgN3
.Ⅰ.下列四支试管中,过氧化氢分解的化学反应速率最大的是
Ⅱ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)实验①和②的目的是
(2)写出实验③的化学反应方程式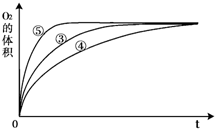
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析如图能够得出的实验结论是
查看习题详情和答案>>
c
c
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| a | 室温(25℃) | 12% | 有 |
| b | 水浴加热(50℃) | 4% | 无 |
| c | 水浴加热(50℃) | 12% | 有 |
| d | 室温(25℃) | 4% | 无 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
探究浓度对反应速率的影响
探究浓度对反应速率的影响
.(2)写出实验③的化学反应方程式
2H2O2 O2↑+2H2O
O2↑+2H2O
 O2↑+2H2O
O2↑+2H2O2H2O2 O2↑+2H2O
O2↑+2H2O
. O2↑+2H2O
O2↑+2H2O
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析如图能够得出的实验结论是
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
.Ⅰ.化合物A是一种酯,它的分子式为C4H8O2,有下图转化关系.试回答下列问题.

(1)A的名称是
(2)B的结构简式是
(3)D中含有的官能团(填名称)
(4)写出B和C生成A的化学方程式
Ⅱ.聚苯乙烯是一种发泡塑料,可用于包装材料等.聚苯乙烯的结构简式为:
试回答下列问题:
(1)聚苯乙烯的单体是(写结构简式):
该单体可发生的化学反应类型有
(2)试推测聚苯乙烯是
查看习题详情和答案>>

(1)A的名称是
乙酸乙酯
乙酸乙酯
.(2)B的结构简式是
CH3COOH
CH3COOH
.(3)D中含有的官能团(填名称)
醛基
醛基
.(4)写出B和C生成A的化学方程式
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
| 浓硫酸 |
| △ |
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
.| 浓硫酸 |
| △ |
Ⅱ.聚苯乙烯是一种发泡塑料,可用于包装材料等.聚苯乙烯的结构简式为:

试回答下列问题:
(1)聚苯乙烯的单体是(写结构简式):
CH2=CH(C6H5)
CH2=CH(C6H5)
.该单体可发生的化学反应类型有
加聚反应、氧化反应、取代反应等
加聚反应、氧化反应、取代反应等
.(写两种)(2)试推测聚苯乙烯是
线型
线型
型分子(填“线型”或“体型”),它能否溶解于CHCl3,能
能
.(填“能”或“否”),它具有热塑性
热塑性
性(填“热塑”或“热固”).