题目内容
Ⅰ.将70mL NO和O2的混合气体通入足量的水中.(1)若正好完全反应生成HNO3,则原混合气体中O2和NO各多少毫升?(2)若在相同条件下收集到7mL剩余气体,则原混合气体中O2和NO各多少毫升?
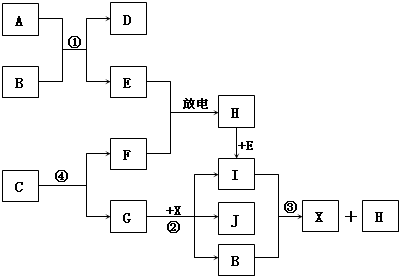
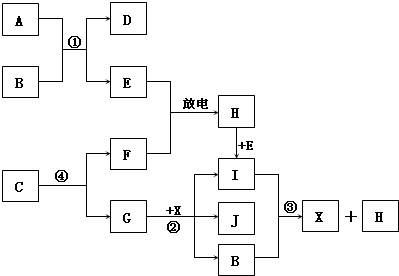
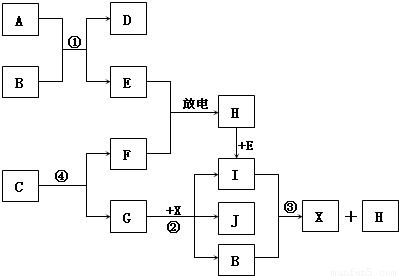
Ⅱ.已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.

(1)D的焰色反应为黄色,则D的化学式为:
(2)写出反应①的离子反应方程式:
写出反应③的离子反应方程式:
(3)写出反应②的化学方程式:
(4)1mol C通过反应④得到1mol G,C中G的质量分数为72%,则C的化学式为:
Ⅱ.已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.

(1)D的焰色反应为黄色,则D的化学式为:
NaOH
NaOH
;F的化学式为N2
N2
;(2)写出反应①的离子反应方程式:
2Na2O2+2H2O═4Na++4OH-+O2↑
2Na2O2+2H2O═4Na++4OH-+O2↑
;写出反应③的离子反应方程式:
3NO2+H2O═2H++2NO3-+NO
3NO2+H2O═2H++2NO3-+NO
.(3)写出反应②的化学方程式:
Ag+2HNO3═AgNO3+NO2↑+H2O
Ag+2HNO3═AgNO3+NO2↑+H2O
.(4)1mol C通过反应④得到1mol G,C中G的质量分数为72%,则C的化学式为:
AgN3
AgN3
.分析:Ⅰ.(1)根据反应4NO+3O2+2H2O═4HNO3来计算,
(2)先考虑剩余气体的成分,然后根据反应4NO+3O2+2H2O═4HNO3,求出参加此反应的NO和O2,最后求出原来的NO和O2
Ⅱ.根据I为红棕色气体,可知I为NO2,则H为NO,E为O2,F为N2;根据反应③,可知这是NO2与水反应生成硝酸和NO,则B为H2O,X为HNO3;根据A为淡黄色固体,能与水反应生成O2,可知A为Na2O2,D为NaOH;根据J与盐酸反应生成不溶于X的白色沉淀,可知X为氯化银,G为Ag,反应④根据质量守恒,可知C中含有氮和银两种元素,再根据1mol C通过反应④得到1mol G,说明1个C中含有1个Ag,C中G的质量分数为72%,则C的相对分子量为150,所以1个C中含有3个N,从而求出化学式.
(2)先考虑剩余气体的成分,然后根据反应4NO+3O2+2H2O═4HNO3,求出参加此反应的NO和O2,最后求出原来的NO和O2
Ⅱ.根据I为红棕色气体,可知I为NO2,则H为NO,E为O2,F为N2;根据反应③,可知这是NO2与水反应生成硝酸和NO,则B为H2O,X为HNO3;根据A为淡黄色固体,能与水反应生成O2,可知A为Na2O2,D为NaOH;根据J与盐酸反应生成不溶于X的白色沉淀,可知X为氯化银,G为Ag,反应④根据质量守恒,可知C中含有氮和银两种元素,再根据1mol C通过反应④得到1mol G,说明1个C中含有1个Ag,C中G的质量分数为72%,则C的相对分子量为150,所以1个C中含有3个N,从而求出化学式.
解答:解:Ⅰ.(1)根据反应4NO+3O2+2H2O═4HNO3可知:
当V(NO):V(O2)=4:3时,恰好完全反应,又V(NO)+V(O2)=70mL 所以:V(NO)=40mL,V(O2)=30mL,
答:原混合气体中O2和NO分别为30ml、40ml;
(2)当剩余的气体为NO时,则消耗了V(NO)+V(O2)=70-7=63mL 又因为消耗的V(NO):V(O2)=4:3,
则V(NO)=36mL,V(O2)=27mL,
∴原混合气体中V(NO)=36+7=43mL,V(O2)=27mL,
当剩余的气体为O2时,则消耗了V(NO)+V(O2)=70-7=63mL 又消耗的V(NO):V(O2)=4:3
则V(NO)=36mL,V(O2)=27mL,
∴原混合气体中V(NO)=36mL,V(O2)=(27+7)=34mL,
答:若在相同条件下收集到7mL剩余气体,若氧气过量,则原混合气体中O2和NO分别为27 ml、43ml;若若一氧化氮气过量,则原混合气体中O2和NO分别为34 ml、36ml;
Ⅱ.因I为红棕色气体,可知I为NO2,则H为NO,E为O2,F为N2;因反应③,可知这是NO2与水反应生成硝酸和NO,则B为H2O,X为HNO3;因A为淡黄色固体,能与水反应生成O2,可知A为Na2O2,D为NaOH;因J与盐酸反应生成不溶于X的白色沉淀,可知X为氯化银,G为Ag,反应④根据质量守恒,可知C中含有氮和银两种元素,再因1mol C通过反应④得到1mol G,说明1个C中含有1个Ag,C中G的质量分数为72%,则C的相对分子量为150,所以1个C中含有3个N,从而求出化学式为AgN3.
故答案为:(1)NaOH; N2;
(2)2Na2O2+2H2O═4Na++4OH-+O2;3NO2+H2O═2H++2NO3-+NO;
(3)Ag+2HNO3═AgNO3+NO2↑+H2O;
(4)AgN3.
当V(NO):V(O2)=4:3时,恰好完全反应,又V(NO)+V(O2)=70mL 所以:V(NO)=40mL,V(O2)=30mL,
答:原混合气体中O2和NO分别为30ml、40ml;
(2)当剩余的气体为NO时,则消耗了V(NO)+V(O2)=70-7=63mL 又因为消耗的V(NO):V(O2)=4:3,
则V(NO)=36mL,V(O2)=27mL,
∴原混合气体中V(NO)=36+7=43mL,V(O2)=27mL,
当剩余的气体为O2时,则消耗了V(NO)+V(O2)=70-7=63mL 又消耗的V(NO):V(O2)=4:3
则V(NO)=36mL,V(O2)=27mL,
∴原混合气体中V(NO)=36mL,V(O2)=(27+7)=34mL,
答:若在相同条件下收集到7mL剩余气体,若氧气过量,则原混合气体中O2和NO分别为27 ml、43ml;若若一氧化氮气过量,则原混合气体中O2和NO分别为34 ml、36ml;
Ⅱ.因I为红棕色气体,可知I为NO2,则H为NO,E为O2,F为N2;因反应③,可知这是NO2与水反应生成硝酸和NO,则B为H2O,X为HNO3;因A为淡黄色固体,能与水反应生成O2,可知A为Na2O2,D为NaOH;因J与盐酸反应生成不溶于X的白色沉淀,可知X为氯化银,G为Ag,反应④根据质量守恒,可知C中含有氮和银两种元素,再因1mol C通过反应④得到1mol G,说明1个C中含有1个Ag,C中G的质量分数为72%,则C的相对分子量为150,所以1个C中含有3个N,从而求出化学式为AgN3.
故答案为:(1)NaOH; N2;
(2)2Na2O2+2H2O═4Na++4OH-+O2;3NO2+H2O═2H++2NO3-+NO;
(3)Ag+2HNO3═AgNO3+NO2↑+H2O;
(4)AgN3.
点评:此题是一道推断题,解题的关键是能对相关物质特征的了解,涉及到的化学反应较多需要学生有较高的分析问题能力.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目