网址:http://m.1010jiajiao.com/timu_id_243254[举报]
铝镁合金是轮船制造、化工生产等行业的重要材料.为测定某铝镁合金(不含其它元素)中镁的质量分数,某实验小组设计了下列实验方案,每个方案均称取5.4g粉末状样品进行探究.请按要求回答下列问题:
[实验1]铝镁合金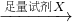 测定剩余固体质量.
测定剩余固体质量.
已知:试剂X焰色反应为黄色.
(1)将称量好的样品放入V1 mL 2.0mol/L试剂X中,充分反应.此反应的离子方程式为______;V1的取值范围是______mL.
(2)经过滤、干燥、称量固体,测得镁的质量分数______(填“偏高”或“无影响”或“偏低”),其原因是______.
[实验2]铝镁合金 测定数据
测定数据
(1)欲计算镁的质量分数,该实验还需测定的数据是______.
(2)若用空气代替O2进行实验,则测定镁的质量分数将______填“偏高”或“无影响”或“偏低”).[已知:3Mg+N2 Mg3N2]
Mg3N2]
[实验3]铝镁合金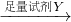 测定生成无色气体的体积
测定生成无色气体的体积
实验装置如下图:
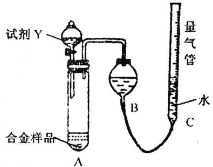
(1)该实验在盛装药品之前应首先进行的实验步骤是______.
(2)同学甲选定试剂Y进行实验,当发现装置A中样品迅速溶解完全后,立即调整量气管C中液面与B中液面相平,测得产生气体体积为V2L[已折算为标准状况下,A中液体体积忽略不计,下述(3)中同].试剂Y的名称是______.所测镁的质量分数偏低的理由是______.
(3)同学乙将试剂Y换为实验1中的试剂X,假设操作均正确,充分反应后测得产生气体体积为V3L,则镁的质量分数为______(含V3的表达式).
查看习题详情和答案>>
 等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
等)中模拟工业生产来提取镁,主要过程如下,回答下列问题: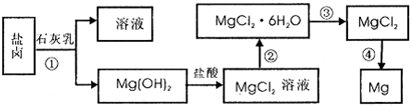
(2)写出转化④中发生反应的化学方程式__________________
(3)已知转化③的反应原理与制取无水AlCl3相同,下图是制取无水AlCl3实验装置图。装置A中的两液体分别是浓硫酸和浓盐酸。请回答:

②分液漏斗中应盛装的试剂是_________;
③由分液漏斗向烧瓶中加试剂时应注意的事项是_________
(4)含有铝元素的另一物质明矾作为膨化剂炸油条(饼)或膨化食品时,若在面粉里加入小苏打后,再加入明矾,则会使等量的小苏打释放出比单放小苏打多一倍的二氧化碳,这样就可以使油条(饼)在热油锅中一下子就鼓起来,得到香脆可口的油条(饼)了。请用化学反应方程式解释得到香脆可口的油条(饼)的原因:_____________________。
[实验l]铝镁合金
| 足量试剂X |
已知:试剂X焰色反应为黄色.
(1)将称量好的样品放入V1mL 2.0mol/L试剂X中,充分反应.此反应的离子方程式为
(2)经过滤、干燥、称量固体,测得镁的质量分数
[实验2]铝镁合金
| 足量O2充分灼烧 |
| 密封(容器带自由移动的活塞) |
(l)欲计算镁的质量分数,该实验还需测定的数据是
(2)若用空气代替O2进行实验,则测定镁的质量分数将
| ||
[实验3]铝镁合金
| 足量试剂Y |
实验装置如下图:
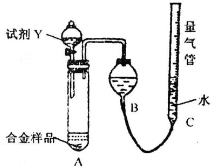
(1)该实验在盛装药品之前应首先进行的实验步骤是
(2)同学甲选定试剂Y进行实验,当发现装置A中样品迅速溶解完全后,立即调整量气管C中液面与B中液面相平,测得产生气体体积为V2L[已折算为标准状况下,A中液体体积忽略不计,下述(3)中同].试剂Y的名称是
(3)同学乙将试剂Y换为实验1中的试剂X,假设操作均正确,充分反应后测得产生气体体积为V3L,则镁的质量分数为
| 1-V3 |
| 6.72 |
| 1-V3 |
| 6.72 |
(13分)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是________________ _______。
(3)将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是___ ____(填序号);记录C的液面位置时,除视线平视外,还应___ ___。
(4)B中发生反应的化学方程式为___________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为__ ______。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”或“不受影响”)。
查看习题详情和答案>>
(13分)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是________________ _______。
(3)将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是___ ____(填序号);记录C的液面位置时,除视线平视外,还应___ ___。
(4)B中发生反应的化学方程式为___________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为__ ______。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”或“不受影响”)。