题目内容
铝镁合金是轮船制造、化工生产等行业的重要材料.为测定某铝镁合金(不含其它元素)中镁的质量分数,某实验小组设计了下列实验方案,每个方案均称取5.4g粉末状样品进行探究.请按要求回答下列问题:
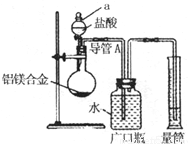
[实验1]铝镁合金 测定剩余固体质量.
测定剩余固体质量.
已知:试剂X焰色反应为黄色.
(1)将称量好的样品放入V1 mL 2.0mol/L试剂X中,充分反应.此反应的离子方程式为______;V1的取值范围是______mL.
(2)经过滤、干燥、称量固体,测得镁的质量分数______(填“偏高”或“无影响”或“偏低”),其原因是______.
[实验2]铝镁合金 测定数据
测定数据
(1)欲计算镁的质量分数,该实验还需测定的数据是______.
(2)若用空气代替O2进行实验,则测定镁的质量分数将______填“偏高”或“无影响”或“偏低”).[已知:3Mg+N2 Mg3N2]
Mg3N2]
[实验3]铝镁合金 测定生成无色气体的体积
测定生成无色气体的体积
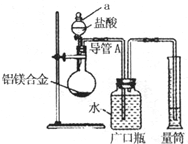
实验装置如下图:
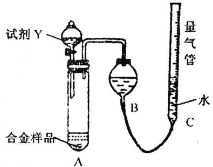
(1)该实验在盛装药品之前应首先进行的实验步骤是______.
(2)同学甲选定试剂Y进行实验,当发现装置A中样品迅速溶解完全后,立即调整量气管C中液面与B中液面相平,测得产生气体体积为V2L[已折算为标准状况下,A中液体体积忽略不计,下述(3)中同].试剂Y的名称是______.所测镁的质量分数偏低的理由是______.
(3)同学乙将试剂Y换为实验1中的试剂X,假设操作均正确,充分反应后测得产生气体体积为V3L,则镁的质量分数为______(含V3的表达式).
解:
[实验1]
(1)试剂X焰色反应为黄色,应为NaOH,发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,其离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,假设5.4g均为Al,n(Al)=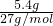 =0.2mol,需要的氢氧化钠为0.2mol,其体积为
=0.2mol,需要的氢氧化钠为0.2mol,其体积为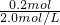 =0.1L=100mL,实际需要氢氧化钠溶液的体积V1≥100mL,
=0.1L=100mL,实际需要氢氧化钠溶液的体积V1≥100mL,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;≥100mL;
(2)若没有洗涤,则镁上会附着偏铝酸钠等物质,即未洗涤导致测定的镁的质量偏高,故答案为:偏高;过滤后没有洗涤;
[实验2]
(1)Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,故答案为:灼烧后固体的质量;
(2)若用空气代替O2进行实验,发生3Mg+N2 Mg3N2,2Mg+CO2
Mg3N2,2Mg+CO2 2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:偏高;
2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:偏高;
[实验3]
(1)测定气体的体积,应先检查装置的气密性,所以该实验在盛装药品之前应首先进行的实验步骤为检查装置的气密性,故答案为:检查装置的气密性;
(2)因金属与稀盐酸或稀硫酸的反应生成氢气,反应为放热反应,温度升高,测定的氢气的体积偏大,又Al的含量越大,生成氢气越多,则氢气的体积大时计算出Mg的质量分数偏低,
故答案为:稀盐酸或稀硫酸;放热反应,温度升高,测定的氢气的体积偏大,又Al的含量越大,生成氢气越多,则氢气的体积大时计算出Mg的质量分数偏低;
(3)试剂Y换为实验1中的试剂X,由2Al+2NaOH+H2O═2NaAlO2+3H2↑可知,n(H2)= mol,则n(Al)=
mol,则n(Al)=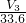 mol,Al的含量为
mol,Al的含量为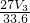 g,所以Mg的质量分数为
g,所以Mg的质量分数为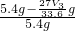 ×100%=
×100%=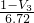 ×100%,故答案为:
×100%,故答案为: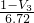 ×100%.
×100%.
分析:
[实验1]
(1)试剂X焰色反应为黄色,应为NaOH,发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
[实验2]
(1)Mg、Al均与氧气反应;
(2)若用空气代替O2进行实验,发生3Mg+N2 Mg3N2,2Mg+CO2
Mg3N2,2Mg+CO2 2MgO+C,测定生成固体的质量变大;
2MgO+C,测定生成固体的质量变大;
[实验3]
(1)测定气体的体积,应先检查装置的气密性;
(2)发生金属与稀酸的反应生成氢气,Al的含量越大,生成氢气越多;
(3)试剂Y换为实验1中的试剂X,利用2Al+2NaOH+H2O═2NaAlO2+3H2↑计算出Al的含量,再计算Mg的质量分数.
点评:本题考查学生金属镁和金属铝的化学性质以及化学实验方案的设计知识,注意实验原理及实验中发生的化学反应,题目综合性较强,题目难度中等,注重学生开放性思维的训练.

 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.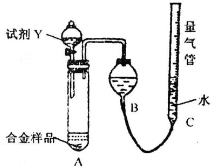
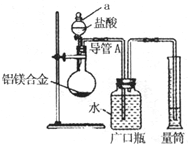 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案. 测定生成气体在标准状况下的体积(V1L)
测定生成气体在标准状况下的体积(V1L) 充分反应后测定剩余固体的质量(W1g)
充分反应后测定剩余固体的质量(W1g) 测定生成气体在标准状况下的体积(V2L).
测定生成气体在标准状况下的体积(V2L). 测定生成气体在标准状况下的体积(V1L)
测定生成气体在标准状况下的体积(V1L)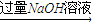 充分反应后测定剩余固体的质量(W1g)
充分反应后测定剩余固体的质量(W1g) 溶液
溶液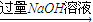 过滤,测定沉淀的质量(W2g)
过滤,测定沉淀的质量(W2g) 测定生成气体在标准状况下的体积(V2L).
测定生成气体在标准状况下的体积(V2L).