摘要:A.同位素:.. B.分子晶体:..固态氩
网址:http://m.1010jiajiao.com/timu_id_239792[举报]
1
2
3
4
5
6
7
8
A
B
C
D
B
C
D
A
9
10
11
12
13
14
15
16
D
A
C
C
A
D
B
B
17.(1)促进, B (2)甲大 (各1分)
乙用氯化铵溶液稀释后,.files/image325.gif) 增大很多,使
增大很多,使.files/image212.gif) 的电离平衡向抑制电离的方向移动;
的电离平衡向抑制电离的方向移动;.files/image328.gif) 发生水解,使稀释后的乙溶液的
发生水解,使稀释后的乙溶液的.files/image330.gif) )增大 (答
)增大 (答.files/image328.gif) 水解使溶液
水解使溶液.files/image153.gif) 减小不给分) (2分)
减小不给分) (2分)
(3)③ 适量的.files/image036.gif) (各1分)
(各1分)
18.(1).files/image335.gif) ,
,.files/image337.gif) ;(各2分)
;(各2分)
(2)①.files/image261.gif) (1分) ②
(1分) ②.files/image340.gif) (1分)
(1分)
得.files/image342.gif)
.files/image343.gif) |
.files/image344.gif)
.files/image345.gif) ③
③.files/image347.gif) (2分)
(2分)
得.files/image349.gif)
④ 1:2 (2分)
19.(1) .files/image351.gif) (各2分)
(各2分)
(2) .files/image353.gif)
(3)0.5 1 (4) D
20.(1)第三周期.files/image355.gif) 族(2分)
族(2分)
(2) .files/image030.gif) 属于分子晶体而
属于分子晶体而.files/image358.gif) 属于原子晶体(2分)
属于原子晶体(2分)
(3) .files/image360.gif) (2分)
(2分)
(4).files/image362.gif) 、
、.files/image364.gif) 、
、.files/image366.gif) 、
、.files/image368.gif) (写出3种即可)(3分)
(写出3种即可)(3分)
21.(1) ③⑤⑦ (2) C (各2分)
22.(1).files/image076.gif) 、
、.files/image030.gif) 等(2分)
等(2分)
(2).files/image372.gif) ;
;.files/image374.gif) ;
;.files/image012.gif) (各1分)
(各1分)
(3)① .files/image377.gif) (1分)
(1分)
②a、b (各1分) .files/image379.gif) (1分) 双手紧握 (或微热) 试管丁使试管中气体逸出,
(1分) 双手紧握 (或微热) 试管丁使试管中气体逸出,.files/image034.gif) 与水接触后即可引发烧杯中的水倒流入试管丁(2分)
与水接触后即可引发烧杯中的水倒流入试管丁(2分)
③
.files/image382.gif) (2分)
(2分)
23.(1).files/image186.gif) (2)
(2).files/image385.gif) (3)
(3).files/image387.gif) (4)
(4) .files/image389.gif) (各2分)
(各2分)
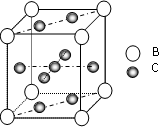 A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:
A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:(1)A、B原子处于基态时,原子核外电子均成对,且核电荷数A>B 写出A的基态外围电子轨道表示式


(2)C与A在周期表同属于一个区的元素,写C2+的核外电子排布式
[Ar]3d9
[Ar]3d9
.(3)图是金属B和C所形成的某种合金的晶胞结构示意图,用最简式表示该合金中的组成
CaCu5
CaCu5
.(用B、C元素符号表示)(4)C2+和A2+都能与NH3、H2O、Cl-等形成配位数为4的配合物.[A(NH3)4]2+和[C (NH3)4]2+都具有对称的空间构型,[C(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,而[A(NH3)4]2+中的两个NH3被两个Cl-取代,只能得到一种产物,则[C(NH3)4]2+的空间构型为
平面正方形
平面正方形
.[A(NH3)4]2+A原子轨道的杂化方式为sp3
sp3
.(5)D、E、F均位于P区,电负性D<E<F,第一电离能D<F<E,D只有一个未成对电子.D在元素周期表中有位置是
第四周期第IIIA族
第四周期第IIIA族
,D、E形成化合物的化学式GaAs
GaAs
,该化合物的一种用途是半导体材料
半导体材料
F的最高价氧化物对水化物的分子式为H2SeO4
H2SeO4
.A、B、C、D都是短周期元素,原子半径D>C>A>B.已知:A、B位于同一周期;A、C位于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外电子层上的电子数是D原子最外电子层上的电子数的4倍.试回答:
(1)这四种元素名称分别是:
A
(2)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式
(3)B、C形成化合物属
(4)B、D形成的化合物与A、B形成的化合物反应放出B单质,反应方程式为
查看习题详情和答案>>
(1)这四种元素名称分别是:
A
碳
碳
,C硅
硅
,D钠
钠
.(2)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式
Na2CO3+SiO2
Na2 SiO3+CO2
| ||
Na2CO3+SiO2
Na2 SiO3+CO2
.
| ||
(3)B、C形成化合物属
原子
原子
晶体.(4)B、D形成的化合物与A、B形成的化合物反应放出B单质,反应方程式为
2Na2O2+2CO2=2Na2 CO3+O2
2Na2O2+2CO2=2Na2 CO3+O2
. A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:
A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:| C | |
| E |
(1)D、E组成的常见的化合物,其水溶液呈碱性,原因是
S2-+H2O=HS-+OH-
S2-+H2O=HS-+OH-
(用离子方程式表示).(2)E的单质能跟D的最高价氧化物对应水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式
3S+6OH-=2S2-+SO32-+3H2O
3S+6OH-=2S2-+SO32-+3H2O
.(3)C、F所形成的化合物为离子化合物,其晶体结构模型如下:该离子化合物的化学式为
CaF2
CaF2
.(4)4.0gE的单质在足量的B的单质中完全燃烧,放出37.0kJ热量,写出其热化学方程式:
S(s)+O2(g)═SO2(g);△H=-296kJ/mol
S(s)+O2(g)═SO2(g);△H=-296kJ/mol
.(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH浓溶液,两极均有特制的防止气体透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的
负
负
极;B极的电极反应式是O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.A、B、C、D、E都是短周期元素,原子序数依次增大,五种元素核电荷总数为42,B、C同周期,A、D同主族.A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是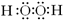
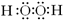 ,C元素在周期表中的位置是
,C元素在周期表中的位置是
(2)C和D的离子中,半径较小的是
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是
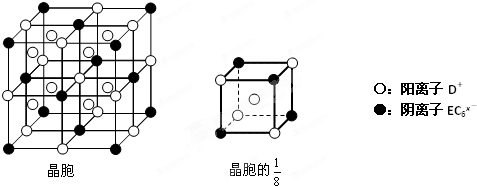
查看习题详情和答案>>
(1)甲、乙两分子中含有非极性共价键的物质的电子式是
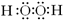
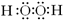
第二周期、第ⅦA族
第二周期、第ⅦA族
.(2)C和D的离子中,半径较小的是
Na+
Na+
(填离子符号).(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是
Na3AlF6
Na3AlF6
.
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:
(2)写出E元素的元素符号: ,其价电子排布图为:
(3)A与D形成化合物的化学式为 ,是 分子(填“极性”或“非极性”)
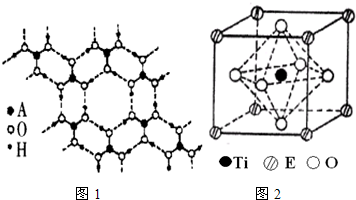
(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是 ,该晶体属于 晶体.
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为 个、 个.
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为 ,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是 ,E的配位数是 .
查看习题详情和答案>>
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:
(3)A与D形成化合物的化学式为

(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为