题目内容
A、B、C、D、E都是短周期元素,原子序数依次增大,五种元素核电荷总数为42,B、C同周期,A、D同主族.A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是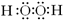
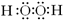 ,C元素在周期表中的位置是
,C元素在周期表中的位置是
(2)C和D的离子中,半径较小的是
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是
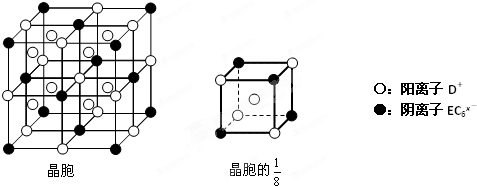
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是
(1)甲、乙两分子中含有非极性共价键的物质的电子式是
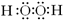
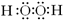
第二周期、第ⅦA族
第二周期、第ⅦA族
.(2)C和D的离子中,半径较小的是
Na+
Na+
(填离子符号).(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心.该化合物的化学式是
Na3AlF6
Na3AlF6
.
分析:A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,A、B、C、D、E都是短周期元素,原子序数依次增大,所以A和B分别是H元素和O元素;A、D同主族,且D的原子序数大于B,为短周期元素,所以D是Na元素;B、C同周期,C的原子序数大于B,所以是F元素;五种元素核电荷总数为42,且E的原子序数大于D,所以Al元素.
(1)根据共价化合物电子式的书写方法书写;主族元素的电子层数等于其周期数,最外层电子数和其主族序数相等.
(2)电子层结构相同的离子,离子半径随着原子序数的增大而减小.
(3)铝和氢氧化钠反应生成偏铝酸钠和氢气.
(4)利用均摊法确定化学式.
(1)根据共价化合物电子式的书写方法书写;主族元素的电子层数等于其周期数,最外层电子数和其主族序数相等.
(2)电子层结构相同的离子,离子半径随着原子序数的增大而减小.
(3)铝和氢氧化钠反应生成偏铝酸钠和氢气.
(4)利用均摊法确定化学式.
解答:解:A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,A、B、C、D、E都是短周期元素,原子序数依次增大,所以A和B分别是H元素和O元素;A、D同主族,且D的原子序数大于B,为短周期元素,所以D是Na元素;B、C同周期,C的原子序数大于B,所以是F元素;五种元素核电荷总数为42,且E的原子序数大于D,所以Al元素.
(1)甲、乙两分子中含有非极性共价键的物质是双氧水,其电子式为: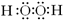 ;铝原子的核外有2个电子层,最外层上有3个电子,故在元素周期表中的位置是第二周期、第ⅦA族.
;铝原子的核外有2个电子层,最外层上有3个电子,故在元素周期表中的位置是第二周期、第ⅦA族.
故答案为: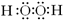 ;第二周期、第ⅦA族.
;第二周期、第ⅦA族.
(2)电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以钠离子的半径较小.
故答案为:Na+.
(3)铝和氢氧化钠反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)该晶胞的
中含有的钠离子个数=1+4×
=
,阴离子EC6x-个数=4×
=
,所以其化学式中阴阳离子个数之比为1:3,化学式为Na3AlF6.
故答案为:Na3AlF6.
(1)甲、乙两分子中含有非极性共价键的物质是双氧水,其电子式为:
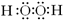 ;铝原子的核外有2个电子层,最外层上有3个电子,故在元素周期表中的位置是第二周期、第ⅦA族.
;铝原子的核外有2个电子层,最外层上有3个电子,故在元素周期表中的位置是第二周期、第ⅦA族.故答案为:
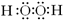 ;第二周期、第ⅦA族.
;第二周期、第ⅦA族. (2)电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以钠离子的半径较小.
故答案为:Na+.
(3)铝和氢氧化钠反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)该晶胞的
| 1 |
| 8 |
| 1 |
| 8 |
| 3 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:Na3AlF6.
点评:本题以元素推断为载体考查了电子式的书写、元素位置的确定、离子半径大小的比较、化学式的确定等知识点,能正确推断元素是解本题的关键,难度不大.

练习册系列答案
相关题目
 CH3COOH+OH-
CH3COOH+OH- 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是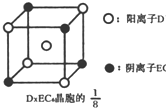
 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.