题目内容
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:
(2)写出E元素的元素符号: ,其价电子排布图为:
(3)A与D形成化合物的化学式为 ,是 分子(填“极性”或“非极性”)
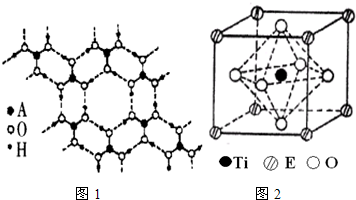
(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是 ,该晶体属于 晶体.
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为 个、 个.
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为 ,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是 ,E的配位数是 .
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:
(3)A与D形成化合物的化学式为

(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为
分析:A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,
C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键,说明C属于非金属元素,如果s轨道含有4个电子,则C是O元素,如果s轨道含有6个电子,则C是Mg元素,镁和非金属元素易形成离子键,所以C是O元素;
A的第一电离能低于同周期左右相邻元素,根据元素周期律知,该元素位于第IIIA族或第VIA族,且原子序数小于C,则A是B元素;
B原子中成对电子数等于未成对电子数的2倍,且原子序数大于A而小于C,则B是C元素;
D与A、B、C均不同周期,其一个单质分子中只有一个σ键,且原子序数大于8则D是Cl元素;
E的原子序数比所处周期中未成对电子数最多的元素大3,第四周期中,未成对电子数最多的元素是Cr,其原子序数是24,则E是Co元素,
再结合物质的结构来分析解答.
C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键,说明C属于非金属元素,如果s轨道含有4个电子,则C是O元素,如果s轨道含有6个电子,则C是Mg元素,镁和非金属元素易形成离子键,所以C是O元素;
A的第一电离能低于同周期左右相邻元素,根据元素周期律知,该元素位于第IIIA族或第VIA族,且原子序数小于C,则A是B元素;
B原子中成对电子数等于未成对电子数的2倍,且原子序数大于A而小于C,则B是C元素;
D与A、B、C均不同周期,其一个单质分子中只有一个σ键,且原子序数大于8则D是Cl元素;
E的原子序数比所处周期中未成对电子数最多的元素大3,第四周期中,未成对电子数最多的元素是Cr,其原子序数是24,则E是Co元素,
再结合物质的结构来分析解答.
解答:解:A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,
C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键,说明C属于非金属元素,如果s轨道含有4个电子,则C是O元素,如果s轨道含有6个电子,则C是Mg元素,镁和非金属元素易形成离子键,所以C是O元素;
A的第一电离能低于同周期左右相邻元素,根据元素周期律知,该元素位于第IIIA族或第VIA族,且原子序数小于C,则A是B元素;
B原子中成对电子数等于未成对电子数的2倍,且原子序数大于A而小于C,则B是C元素;
D与A、B、C均不同周期,其一个单质分子中只有一个σ键,且原子序数大于8则D是Cl元素;
E的原子序数比所处周期中未成对电子数最多的元素大3,第四周期中,未成对电子数最多的元素是Cr,其原子序数是24,则E是Co元素,
(1)与氢元素形成的X2Y2型非极性分子的元素是C元素,该分子为乙炔,乙炔的结构式为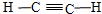 ,故答案为:
,故答案为: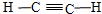 ;
;
(2)E是Co元素,其4s能级上有2个电子,3d能级上有7个电子,3d和4s能级上电子为其价电子,所以其价电子排布图为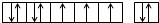 ,故答案为:Co;
,故答案为:Co; ;
;
(3)A是B元素,D是Cl元素,二者形成的化合物是BCl3,该分子中为平面正三角形结构,正负电荷重心重合,为非极性分子,故答案为:BCl3;非极性;
(4)该晶体的构成微粒是分子,且该晶体中分子之间存在范德华力和氢键,故答案为:氢键和范德华力; 分子;
(5)根据图知,1个Ti原子周围距离最近的O原子数目是6,1个E原子周围距离最近的O原子数目=3×8×
=12,
故答案为:6;12;
(6)N3-中中心原子价层电子对个数是2且不含孤电子对,所以其空间构型为直线形,[Co(N3)(NH3)5]SO4中配体是NH3和N3ˉ,E的配位数是6,
故答案为:直线形;NH3和N3ˉ;6.
C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键,说明C属于非金属元素,如果s轨道含有4个电子,则C是O元素,如果s轨道含有6个电子,则C是Mg元素,镁和非金属元素易形成离子键,所以C是O元素;
A的第一电离能低于同周期左右相邻元素,根据元素周期律知,该元素位于第IIIA族或第VIA族,且原子序数小于C,则A是B元素;
B原子中成对电子数等于未成对电子数的2倍,且原子序数大于A而小于C,则B是C元素;
D与A、B、C均不同周期,其一个单质分子中只有一个σ键,且原子序数大于8则D是Cl元素;
E的原子序数比所处周期中未成对电子数最多的元素大3,第四周期中,未成对电子数最多的元素是Cr,其原子序数是24,则E是Co元素,
(1)与氢元素形成的X2Y2型非极性分子的元素是C元素,该分子为乙炔,乙炔的结构式为
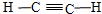 ,故答案为:
,故答案为: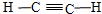 ;
;(2)E是Co元素,其4s能级上有2个电子,3d能级上有7个电子,3d和4s能级上电子为其价电子,所以其价电子排布图为
 ,故答案为:Co;
,故答案为:Co; ;
;(3)A是B元素,D是Cl元素,二者形成的化合物是BCl3,该分子中为平面正三角形结构,正负电荷重心重合,为非极性分子,故答案为:BCl3;非极性;
(4)该晶体的构成微粒是分子,且该晶体中分子之间存在范德华力和氢键,故答案为:氢键和范德华力; 分子;
(5)根据图知,1个Ti原子周围距离最近的O原子数目是6,1个E原子周围距离最近的O原子数目=3×8×
| 1 |
| 2 |
故答案为:6;12;
(6)N3-中中心原子价层电子对个数是2且不含孤电子对,所以其空间构型为直线形,[Co(N3)(NH3)5]SO4中配体是NH3和N3ˉ,E的配位数是6,
故答案为:直线形;NH3和N3ˉ;6.
点评:本题考查了物质结构及性质,明确原子结构及元素在周期表中的位置是解本题关键,特别是第四周期B族和第VIII族元素的原子结构,这部分考查涉及知识点较广,几乎把物质结构中的所有知识点概括,为高考常考查模式,要把教材基础知识掌握扎实,灵活运用基础知识来分析解答,难度中等.

练习册系列答案
相关题目






 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )