题目内容
A、B、C、D都是短周期元素,原子半径D>C>A>B.已知:A、B位于同一周期;A、C位于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外电子层上的电子数是D原子最外电子层上的电子数的4倍.试回答:
(1)这四种元素名称分别是:
A
(2)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式
(3)B、C形成化合物属
(4)B、D形成的化合物与A、B形成的化合物反应放出B单质,反应方程式为
(1)这四种元素名称分别是:
A
碳
碳
,C硅
硅
,D钠
钠
.(2)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式
Na2CO3+SiO2
Na2 SiO3+CO2
| ||
Na2CO3+SiO2
Na2 SiO3+CO2
.
| ||
(3)B、C形成化合物属
原子
原子
晶体.(4)B、D形成的化合物与A、B形成的化合物反应放出B单质,反应方程式为
2Na2O2+2CO2=2Na2 CO3+O2
2Na2O2+2CO2=2Na2 CO3+O2
.分析:根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为: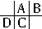 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素,根据元素对应原子的结构判断元素在周期表中的位置,结合元素对应化合物的性质解答该题.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素,根据元素对应原子的结构判断元素在周期表中的位置,结合元素对应化合物的性质解答该题.
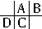 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素,根据元素对应原子的结构判断元素在周期表中的位置,结合元素对应化合物的性质解答该题.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素,根据元素对应原子的结构判断元素在周期表中的位置,结合元素对应化合物的性质解答该题.解答:解:根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为: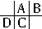 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素.
(1)由上述分析可知,A为碳元素,C为硅元素,D为钠元素.
故答案为:碳;硅;钠.
(2)A为碳元素,B为氧元素,D为钠元素,A、B、D组成的化合物为Na2CO3,B、C组成的化合物为SiO2,碳酸钠与二氧化硅反应方程式为Na2CO3+SiO2
Na2 SiO3+CO2.
故答案为:Na2CO3+SiO2
Na2 SiO3+CO2.
(3)B为氧元素,C为硅元素,B、C组成的化合物为SiO2,SiO2属于原子晶体.
故答案为:原子晶体.
(4)A为碳元素,B为氧元素,D为钠元素,B、D形成的化合物与A、B形成的化合物反应放出B单质,则B、D形成的化合物为Na2O2,A、B形成的化合物为CO2,过氧化钠与二氧化碳反应为2Na2O2+2CO2=2Na2CO3+O2.
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
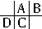 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素.(1)由上述分析可知,A为碳元素,C为硅元素,D为钠元素.
故答案为:碳;硅;钠.
(2)A为碳元素,B为氧元素,D为钠元素,A、B、D组成的化合物为Na2CO3,B、C组成的化合物为SiO2,碳酸钠与二氧化硅反应方程式为Na2CO3+SiO2
| ||
故答案为:Na2CO3+SiO2
| ||
(3)B为氧元素,C为硅元素,B、C组成的化合物为SiO2,SiO2属于原子晶体.
故答案为:原子晶体.
(4)A为碳元素,B为氧元素,D为钠元素,B、D形成的化合物与A、B形成的化合物反应放出B单质,则B、D形成的化合物为Na2O2,A、B形成的化合物为CO2,过氧化钠与二氧化碳反应为2Na2O2+2CO2=2Na2CO3+O2.
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评:本题考查元素位置结构性质的关系及推断,题目难度中等,本题的关键是正确推断元素的种类,注意找出其在周期表中的相对位置.

练习册系列答案
相关题目

