网址:http://m.1010jiajiao.com/timu_id_234010[举报]
溶液中粒子浓度大小的比较
在氯化铵溶液中,下列关系式正确的是
A.C(Cl-)>C(NH4+)>C(H+)>C(OH-) B .C(NH4+)>C(Cl-)>C(H+)>CC(OH-)
C.C(Cl-)=C(NH4+)>C(H+)=C(OH-) D.C(NH4+)=C(Cl-)>C(H+)>C(OH-)
在0.1 mol/l的NH3·H2O溶液中,下列关系正确的是
A.C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+) B.C(NH4+)>C(NH3·H2O)>C(OH-)>C(H+)
C.C(NH3·H2O)>C(NH4+)=C(OH-)>C(H+) D.C(NH3·H2O)>C(NH4+)>C(H+)>C(OH-
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-) B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L
C.C(CH3COOH)>C(CH3COO-) D.C(CH3COO-)+C(OH-)=0.2 mol/L
查看习题详情和答案>>
(1)工业上镍氢电池总反应式为:LaNi5H6+NiOOH
| 放电 |
| 充电 |
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60°C,控温原因可能是
| ||
| ||
(3)氨化过程中应控制溶液pH范围8~9,其原因是
上述流程中,有关说法正确的是(
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl-)>c(NH3?H2O)>c(NH4+)>c(OH-)>c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(4)为测定化合物[Ni(NH3)xCly]Clz?nH2O的组成,进行如下实验:
实验一:称取样品0.6460g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00mL 0.5000mol?L-1的盐酸完全吸收,并用蒸馏水定容至100mL,得溶液B.取B溶液20.00mL,加入指示剂少量,用0.1000mol?L-1NaOH滴定,消耗NaOH溶液20.00mL.
实验二:另取该样品0.6460g,溶于水,以0.1000mol?L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL.相应反应化学方程式为:[Ni(NH3)xCly]Clz+zAgNO3=[Ni(NH3)xCly](NO3)z+zAgCl↓ 测得该镍配合物的化学式为

(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
| 1 |
| x |
2COS(g)+SO2(g)=2CO2(g)+
| 3 |
| x |
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,当生成H3AsO4的物质的量为0.6mol反应中转移电子的数目为
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).
①B表示
②滴加过程中,溶液中微粒浓度大小关系,正确的是
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下所示:

①写出反应器中发生反应的化学方程式是
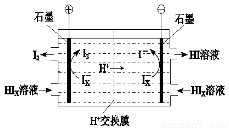
②电渗析装置如图2所示,写出阳极的电极反应式
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/xSx(s)?? △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s)?? △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是????????????????????? 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量为0.6 mol反应中转移电子的数目为??????? ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
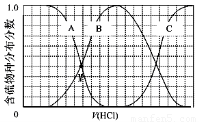
①B表示??? ??????????? 。
②滴加过程中,溶液中微粒浓度大小关系正确的是???? (填字母)。
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为??????????????????????????????????????? 。
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
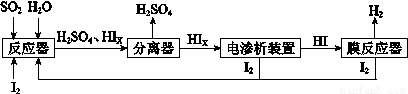
① 写出反应器中发生反应的化学方程式是?????????????????? 。
② 电渗析装置如图所示,写出阳极的电极反应式?????????????? 。该装置中发生的总反应的化学方程式是???????????????? 。
查看习题详情和答案>>