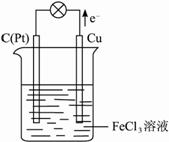
摘要:(1)写出生成E的电极反应式 反应⑤的现象是 (2)反应①的化学方程式是 .在实验室中引发反应④的操作是 .(3)反应⑥的离子方程式是 .山东省潍坊市昌乐一中2009届高三上学期教学质量检测
网址:http://m.1010jiajiao.com/timu_id_214959[举报]
1.A 2.B 3.C 4.B 5.C 6.C 7.B 8.A
9.A 10.C 11.A 12.D 13.B 14.D
15.(共9分)
(1)NO2 (3分)
(2)比较碳酸、醋酸、硅酸的酸性强弱;(3分)B中固体溶解,产生无色气体,C试管中产生白色沉淀(3分)。
16.(17分)
(1)碱性(2分) ClO- + H2O  HClO + OH- (2分)
HClO + OH- (2分)
(2)氧化性 漂白性 不稳定性 (任写两个,每空2分)
(3)CO2等酸性气体、光和热 (2分)
(4)铁钉表面出现铁锈(或红褐色固体) (2分)
(5)铁钉可能未被腐蚀,也可能被腐蚀但无明显现象 (2分)
用试管取出少量浸泡后的溶液,滴加足量的稀硫酸酸化,再滴加几滴KSCN溶液。(3分)
17.(共10分)
(1)取A的样品少量于试管中,加入少量水,若无气泡产生,说明已经完全变质。(2分)
 (2)2Na2SO3+O2=2Na2SO4(2分)
(2)2Na2SO3+O2=2Na2SO4(2分)
(3)SO32-+ClO-= SO42-+Cl- (2分) 2 (2分 )
(4)取H溶液少量于试管中,加入足量Ba(NO3)2溶液,产生白色沉淀,说明含有
SO42-离子;静置,向上层清液中加入少量AgNO3溶液,若产生白色沉淀,说明含有Cl-离子。(2分)
18.(1)蒸发结晶(或蒸发2分)
 Mg(OH)Cl + HCl↑+5H2O(2分)
Mg(OH)Cl + HCl↑+5H2O(2分) Fe3O4+4H2(2分)加入少量KClO3,在KClO3上插上镁条并点燃镁条(2分)
Fe3O4+4H2(2分)加入少量KClO3,在KClO3上插上镁条并点燃镁条(2分)
 CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题: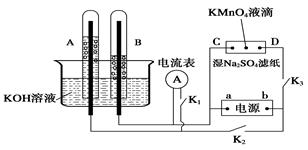
 CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题: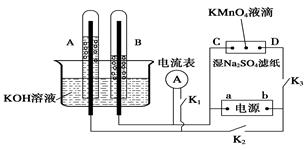
 CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题: