题目内容
Ⅰ.下图表示的反应关系中,部分产物被略去。已知2 mol白色固体粉末X完全分解后,恢复到室温,生成白色固体A、无色液体B、无色气体C各1 mol,X、E、G的焰色反应均为黄色。?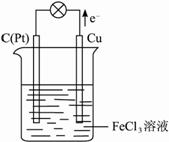
完成下列问题:?
(1)写出下列物质的化学式:X ,G ,?D ?。?
(2)写出G与C反应生成D的化学方程式:?
。?
(3)写出X+E![]() A的离子方程式: 。?
A的离子方程式: 。?
Ⅱ.某反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,试设计一个原电池实现该反应。?
(1)该原电池的电极反应式为:?
正极 ;?
负极 。?
(2)该原电池正极材料为 ,负极材料为 ,电解质溶液是 。?
(3)画出该原电池的示意图,并标出电子流动的方向。?

Ⅰ.(1)NaHCO3 NaAlO2 Al(OH)3?
(2)2NaAlO2 + CO2 + 3H2O = 2Al(OH)3↓+ Na2CO3(或NaAlO2 + CO2 + 2H2O=Al(OH)3↓+NaHCO3)
(3)HCO-3 + OH -= CO2-3 + H2O?
Ⅱ.(1)2Fe3+ + 2e-=2Fe2+? Cu - 2e-=Cu2+??
(2)石墨(或铂)铜棒 FeCl3溶液?
(3)?

?
解析:ⅠX为钠的化合物,2 mol X可分解得到固体A、液态B和气态C各1 mol,C与Na2O2反应得A,结合其他转化很易推出X为NaHCO3、A为Na2CO3、B为H2O、C为CO2、E为NaOH、G为NaAlO2、D为?Al(OH)3?。?
Ⅱ?据方程式2Fe3+ + Cu=2Fe2+ + Cu2+,负极反应为Cu-2e-=Cu2+,正极反应为
2Fe3+ + 2e- =2Fe2+,
故负极材料为铜。由电解质溶液可选用FeCl3。正极材料可选用石墨。

练习册系列答案
相关题目
有关元素A、B、C、D、E、F的信息如下:
请回答下列问题:
(1)写出物质甲与乙反应的离子方程式______
(2)下列说法不正确的是______(填序号).
①实验室可用右图所示装置制取B的最高价氧化物
②用C单质做成的槽车,可用来运输甲的浓溶液
③C和铜与稀硫酸组成的原电池,C电极被还原
(3)若用石墨做电极电解元素D、E组成的化合物饱和水溶液,写出电解反应的离子方程式为:______
(4)已知:2AO2(g) A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
①该反应是由______开始反应的.(填“正反应”、“逆反应”、或“正逆反应同时”.)
②a、b两个点中,表示化学反应处于平衡状态的点是______.
③前10min内用AO2表示的化学反应速率v(AO2)=______mol?L-1?min-1.

| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 最高正价与最低负价代数和为6 |
(1)写出物质甲与乙反应的离子方程式______
(2)下列说法不正确的是______(填序号).
①实验室可用右图所示装置制取B的最高价氧化物
②用C单质做成的槽车,可用来运输甲的浓溶液
③C和铜与稀硫酸组成的原电池,C电极被还原
(3)若用石墨做电极电解元素D、E组成的化合物饱和水溶液,写出电解反应的离子方程式为:______
(4)已知:2AO2(g)
 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.①该反应是由______开始反应的.(填“正反应”、“逆反应”、或“正逆反应同时”.)
②a、b两个点中,表示化学反应处于平衡状态的点是______.
③前10min内用AO2表示的化学反应速率v(AO2)=______mol?L-1?min-1.



 转化率= .
转化率= . 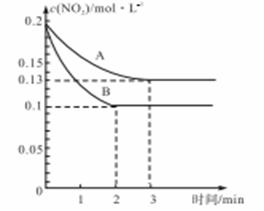 的情报况如下图所示,请回答:
的情报况如下图所示,请回答: